已知反应:2SO2(g)+O2(g) 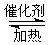 2SO3(g) ΔH<0。某温度下,将2 mol SO2和
2SO3(g) ΔH<0。某温度下,将2 mol SO2和 1 mol O2置于10 L密闭容器中,反应达平衡后
1 mol O2置于10 L密闭容器中,反应达平衡后 ,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
| A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1 |
| B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2 |
| C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
D.压强为0.50 MPa时不同温度下 SO2转化率与温度关系如丙图,则T2>T1 SO2转化率与温度关系如丙图,则T2>T1 |
25℃时,将氨水与氯化铵溶液混合得到 c(NH3·H2O)+c(NH4+) =" 0.1" mol·L-1的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列有关离子浓度关系叙述一定正确的是
| A.W点表示溶液中:c(NH4+) +c(H+) = c(OH-) |
| B.pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3·H2O)<0.1 mol·L-1 |
| C.pH=9.5溶液中:c(NH3·H2O)>c(NH4+)>c(OH-)>c(H+) |
| D.向W点所表示1L溶液中加入0.05molNaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+)>c(OH-)>c(NH4+)>c(H+) |
下列实验操作、现象和结论均正确的是
| 选项 |
实验操作 |
现象 |
结论 |
| A |
淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液,再水浴加热 |
无银镜生成 |
淀粉未发生水解 |
| B |
将一铝箔放在酒精灯外焰上灼烧 |
铝箔熔化但不滴落 |
铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
| C |
铜放入稀硫酸中,再加入硝酸钠固体 |
开始无明显现象,后溶液变蓝,有明显的气泡放出,铜溶解 |
硝酸钠可以加快铜与稀硫酸的反应速率 |
| D |
向2 mL 0.1 mol/L Na2S溶液中滴几滴0.1 mol/L ZnSO4溶液;再加入几滴0.1 mol/L CuSO4溶液 |
先生成白色沉淀,后生成黑色沉淀 |
溶度积(Ksp):ZnS>CuS |
右图是一些常见有机物的转化关系,下列说法正确的是
| A.反应①是加成反应,反应⑧是消去反应,其它所标明的反应都是取代反应 |
| B.上述物质中能与NaOH溶液反应的只有乙酸 |
| C.1,2一二溴乙烷、乙烯、乙醇烃基上的氢被氯取代,其一氯取代产物都是一种 |
| D.等物质的量的乙烯和乙醇与足量氧气反应时耗氧量相同 |
设NA表示阿伏加德罗常数,下列说法正确的是
| A.标准状况下,22.4 LSO3所含电子数约为40 NA |
| B.0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA |
| C.92 g NO2、N2O4混合气体含有的N原子数为2NA |
| D.1 mol Cl2作为氧化剂得到的电子数为NA |
硫酸生产中,其尾气是大气污染来源之一,2SO2(g)+O2(g) 2SO3(g)。现在一种新型纳米材料氧缺位铁酸盐CoFe2OX由铁酸盐CoFe2O4经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。下图是某温度下SO2的平衡转化率(a)与体系总压强(p)的关系,下列说法正确的是
2SO3(g)。现在一种新型纳米材料氧缺位铁酸盐CoFe2OX由铁酸盐CoFe2O4经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。下图是某温度下SO2的平衡转化率(a)与体系总压强(p)的关系,下列说法正确的是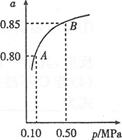
A.新型纳米材料氧缺位铁酸盐CoFe2OX的X的值是5
B.新型纳米材料氧缺位铁酸盐CoFe2OX在将酸性氧化物分解除去的过程中起催化作用
C.温度升高,SO2浓度增大,该反应的焓变为正值
D.平衡状态由A变到B时,平衡常数K(A)=K(B)