用铁片与稀硫酸制氢气时,下列措施有能使反应速率加快的是
| A.加热 | B.不用稀硫酸,改用98%浓硫酸 |
| C.滴加少量硫酸铜溶液 | D.不用铁片,改用铁粉 |
下列化学用语正确的是()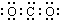
| A.CO2分子的电子式: | B.Cl-的离子结构示意图: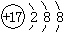 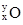 |
C.HClO分子的结构式:H-Cl-O | D.质子数为x,中子数为y的核数: |
钋-210属于极毒性放射性元素,以相同重量来比较,钋-210的毒性是氰化物的2.5亿倍,只需一颗尘埃大小就足以取人性命,而且没有解毒剂。下列有关21084PO说法正确的是()
A.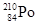 与 与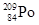 互为同素异形体 互为同素异形体 |
B.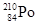 与 与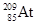 互为同位素 互为同位素 |
C.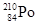 的质子数为84,中子数为126 的质子数为84,中子数为126 |
D.Po元素的相对原子质量为210 |
科学家指出,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷(As)类物质在维生素C的作用下,能够转化为有毒的+3价砷类化合物。有关说法正确的是()
| A.维生素C具有还原性 |
| B.+5价砷既可得电子,又可失电子 |
| C.AsH3的稳定性强于HBr |
| D.上述过程中砷元素发生氧化反应,含+3价砷的物质为氧化产物 |
C、N、S的氧化物中许多是工业上重要的化工原料,但是当它们分散到空气中时,会带来很多环境问题。下列有关这些元素的氧化物说法错误的是()
A.这些氧化物使雨水的pH<7,我们把pH<7的雨水称之为酸雨
B.N与S的某些氧化物能直接危害人的身体健康,引发呼吸道疾病
C.“温室效应”与二氧化碳的排放有着直接的关系
D.开发太阳能、水能、风能、氢能等新能源将有利于减少这些元素的氧化物的产生
在水中加入等物质的量的AgNO3、Ba(NO3)2、NaCl、K2SO4混合均匀.取一定量溶液,用惰性电极电解,片刻后在两个极区析出的氧化产物与还原产物的质量之比为( )
| A.35.5∶108 | B.1∶2 | C.108∶35.5 | D.8∶1 |