将4 mol SO2和2 mol O2在2 L的密闭容器中混合,在一定 条件下发生如下反应:2SO2(g)+O2(g)
条件下发生如下反应:2SO2(g)+O2(g) 2SO3(g)。若经过2s后测得SO3的浓度为0.6 mol/ L,用氧气表示该反应2s内的平均速率V(O2)= ;2s末O2浓度为 ;2s末SO2的转化率为 。
2SO3(g)。若经过2s后测得SO3的浓度为0.6 mol/ L,用氧气表示该反应2s内的平均速率V(O2)= ;2s末O2浓度为 ;2s末SO2的转化率为 。
A、B、C、D四种短周期主族元素在周期表里的相对位置如下图所示。已知他们的原子序数总和为46,则: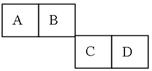
(1)C元素形成的离子结构示意图是:;
(2)元素B的气态氢化物的结构式为;
(3)A与D所形成的最简单化合物中含键,电子式为。
(4)由B、D两氢化物相互作用所生成的物质是,晶体类型为。
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成。乙醇和汽油经加工处理形成的车用燃料即乙醇汽油。
结合有关知识,回答下列问题:
(1)汽油是低沸点的烷烃,其分子中的碳原子数一般在C5~C12范围内,如戊烷,其分子式为。
(2)乙醇分子中的官能团是_______。(填名称)
(3)在试管里加入2mL乙醇。把一端弯成螺旋状的铜丝放在酒精外焰中加热,使铜丝表面生成一薄层氧化铜(黑色),立即把它插入盛有乙醇的试管里(如右图),取出铜丝,可以观察到铜丝表面的变化是,反应的化学方程式是。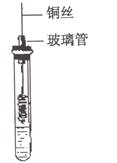
(12 分)在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mo
分)在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mo l SO2进行可逆反应:2SO2(g)+ O2(g)
l SO2进行可逆反应:2SO2(g)+ O2(g) 2SO3(g),2 min后测得O2的物质的量为1.6 mol,则:
2SO3(g),2 min后测得O2的物质的量为1.6 mol,则:
(1)2 min内,SO2的物质的量减少了mol,SO3的物质的量增加了mol;
(2)若用O2的浓度变化来表示该反应的反应速率,则V(O2)=;
(3)若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)=。
下列是元素周期表的前三周期中的部分元素:
族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 一 |
H |
He |
||||||
| 二 |
Li |
C |
N |
O |
F |
|||
| 三 |
Na |
Mg |
S |
Cl |
(1)这些元素中,最活泼的元素是,最不活泼的元素是;
(2)原子结构示意图 所表示的原子是。其单质最硬的元素为。
所表示的原子是。其单质最硬的元素为。
(3)Na和Mg两种元素的最高价氧化物对应的水化物都是碱,则这两种碱的碱性强弱为NaOHMg(OH)2 (填“大于”或“小于”);
(4)请写出由上表第三周期元素形成的一种离子化合物的化学式。
芬必得是一种解热、镇痛及抗生素药物的商品名,其主要成分是化合物对异丁基-α-甲基苯乙酸,药名为布洛芬,它有多种合成路线,其中一种的合成路线如下: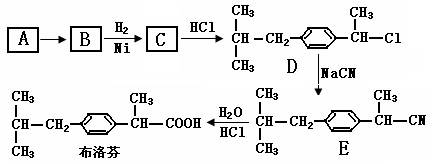
(1)由A生成B反应方程式是: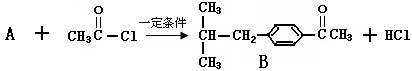
有机物A的结构简式是,该反应的类型是。
(2)由B生成C反应方程式是,反应类型是。
(3)有机物D的官能团是。
(4)根据布洛芬的结构,下列判断不正确的是(填序号)。
| A.能与NaOH溶液反应 | B.苯甲酸的同系物 |
| C.能与溴水发生加成反应使溴水褪色 | D.能使酸性高锰酸钾溶液褪色 |
E.不能发生取代反应 F.1mol布洛芬能与1mol金属钠反应