硫代硫酸钠溶液与稀硫酸的反应方程式为:
Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,
某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)。
(1)实验目的:装置甲,探究浓度对化学反应速率的影响;装置乙,探究 对化学反应速率的影响。
(2)通过甲、乙装置,分别进行了三组实验,数据记录如下,并经分析得出相关结论:
| 实验 组号 |
温度] |
Na2S2O3溶液 |
H2SO4 |
加入H2O的体积 |
出现沉淀所需时间 |
||
| 体积 |
浓度 |
体积 |
浓度 |
||||
| Ⅰ |
0℃ |
5mL |
0.1mol·L-1 |
10mL |
0.1mol·L-1 |
5mL |
8s |
| Ⅱ |
0℃ |
5mL |
0.1mol·L-1 |
5mL |
0.1mol·L-1 |
10mL |
12s |
| Ⅲ |
30℃ |
5mL |
0.1mol·L-1 |
5mL |
0.1mol·L-1 |
10mL |
4s |
结论1:由Ⅰ和Ⅱ两组数据可知 ;
结论2:由Ⅱ和Ⅲ两组数据可知 。
以食盐为原料进行生产并综合利用的某些过程如下图所示。
(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填字母) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)电解饱和食盐水可得到H2和另外两种产物,这两种物质相互反应的离子方程式为 ,欲从饱和食盐水中获得食盐晶体,可采用的实验方法是 。
(4)气体X可增大饱和食盐水吸收CO2的量,有利于NaHCO3晶体的生成和析出,X的化学式是 。
(5)下列有关NaHCO3和纯碱的说法正确的是 (填字母)
| A.NaHCO3属于盐类,纯碱属于碱 |
| B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率相同 |
| C.常温下在水中的溶解度,NaHCO3大于纯碱 |
| D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2 |
下列实验现象预测正确的是
| A.实验I:打开止水夹,烧瓶内出现红色喷泉 |
| B.实验II:酸性KMnO4溶液中出现气泡,颜色无明显变化 |
| C.实验III:静置一段时间,小试管内有晶体析出 |
| D.实验IV:烧杯中液体变为红褐色后,继续加热煮沸,会出现浑浊 |
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。
①通入Cl2 后,观察到的现象是 根据现象可得出的结论是 。
②集气瓶B发生反应的离子方程式是 。
③C装置的作用是 ,若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为 _mol。
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。
①实验开始后,观察装置A 中的现象是 。
②装置C中发生反应的离子方程式是 。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生 反应的离子方程式是 。
(12 分)某工业残渣主要成分为 Fe2O3(含有少量 FeO、Cu、Mg 等杂质)某课外兴趣小组利用该残渣制取Fe2O3粉末的实验流程如下:(说明:流程中向黄色溶液中加入MgO的目的是调节溶液的酸碱性,使Fe3+生成沉淀而Mg2+不沉淀)
请回答下列问题:
(1)加入足量稀盐酸后,发生化学反应的类型有 (填写代号)。
| A.置换反应 |
| B.化合反应 |
| C.分解反应 |
| D.复分解反应 |
E.氧化还原反应
(2)加入适量氯水的作用是 ;
(3)写出灼烧红褐色沉淀时发生反应的化学方程式 。实验室灼烧红褐色沉淀可选用的装置是 (填序号)。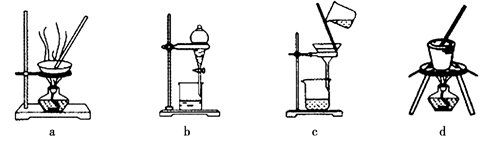
(4)若向黄色溶液中加入过滤①后的滤渣发生反应的离子方程式为 。
(5)检验黄色溶液中 Fe3+是否完全沉淀的方法是:取过滤②后的少量滤液于试管中, (请补充完整实验操作、现象、结论)。
回答实验室配制0.1 mol/L的NaOH 溶液480 mL实验中的下列问题。
(1)需NaOH g。
(2)有以下仪器:①烧杯②100 mL量筒③1000 mL容量瓶④500 mL容量瓶⑤玻璃棒 ⑥托盘天平。
配制时,必须使用的仪器有 ,还缺少的仪器是 。
(3)下列称量NaOH 的操作中,正确的是 (填序号,下同)
①把NaOH直接放在托盘上称量 ②把NaOH放在纸上称量
③把NaOH放入烧杯中称量
(4)使用容量瓶前必须进行的一步操作是 。
(5)配制过程中,下列操作会引起浓度偏高的是 。
①未洗涤烧杯、玻璃棒
②NaOH溶液未冷却至室温就转移到容量瓶中
③容量瓶不干燥,含有少量蒸馏水
④称量NaOH的时间太长
⑤定容时俯视刻度