Ⅰ、某烷烃的质谱图如下
①该烷烃的相对分子量为 ,分子式为 。
②该烷烃的某种同分异构体A的核磁共振氢 谱显示只有一个峰,写出A的结构简式 ,用系统命名法命名为 。
谱显示只有一个峰,写出A的结构简式 ,用系统命名法命名为 。
Ⅱ、某有机物的分子式是C3H4O2,它的水溶 液呈酸性,能跟Na2CO3溶液反应,又能使溴水褪色。写出这种有机物的结构简式 ,写出与溴水反应的化学方程式 。
液呈酸性,能跟Na2CO3溶液反应,又能使溴水褪色。写出这种有机物的结构简式 ,写出与溴水反应的化学方程式 。
(15分)某研究性学习小组将一定浓度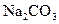 溶液滴入
溶液滴入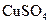 溶液中得到蓝色沉淀。
溶液中得到蓝色沉淀。
甲同学认为两者反应生成只有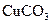 一种沉淀;
一种沉淀;
乙同学认为这两者相互促进水解反应,生成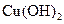 一种沉淀;
一种沉淀;
丙同学认为生成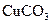 和
和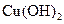 两种沉淀。
两种沉淀。
(查阅资料知: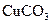 和
和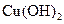 均不带结晶水)
均不带结晶水)
I.按照乙同学的理解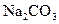 溶液和
溶液和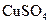 溶液反应的化学反应方程式为;
溶液反应的化学反应方程式为;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为①过滤②洗涤③干燥。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。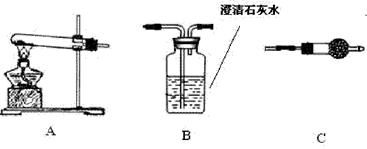
(1)各装置连接顺序为→→。
(2)装置C中装有试剂的名称是。
(3)能证明生成物中有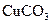 的实验现象是。
的实验现象是。
Ⅲ.若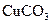 和
和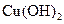 两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。
两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。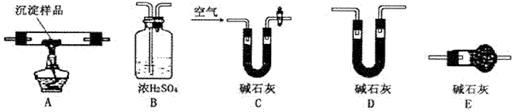
(1)装置C中碱石灰的作用是,实验开始时和实验结束时都要通入过量的空气其作用分别是。
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中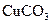 的质量分数为:。
的质量分数为:。
某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:
实验一、把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验二、把纯锌片投入到含FeCl3的同浓度工业盐酸中,发现放出氢气量减少。
实验三、将不纯的锌片与盐酸反应,发现反应速率加快。
实验四、在盐酸中滴入几滴CuCl2溶液,同样生成氢气速率加快。
问题:
(1)试分析实验一中t1~t2速率变化的主要原因是,t2~t3速率变化的主要原因是。
(2)实验二放出氢气量减少的原因是。
(3)某同学认为实验四反应速率加快原因,均为原电池的存在,你认为是否正确,若不正确,说明原因。若正确写出原电池的正、负极及电解质溶液。
(7分)一定温度下,在容积为V L的密闭容器中进行反应:aN(g)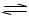 bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中a :b=__________;
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:_________________________;
(3)下列叙述中能说明上述反应达到平衡状态的是_______________。
| A.反应中M与N的物质的量之比为1︰1 |
| B.混合气体的总质量不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内每消耗a mol N,同时生成b mol M |
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
如图所示装置:
(1)若烧杯中溶液为稀硫酸,两极反应式为:
正极;负极。
(2)若烧杯中为氢氧化钠溶液,两极反应式为:
正极;负极。
(3)若烧杯中为氯化钠溶液,两极反应式为:正极;负极。
(8分)某简单微粒的结构示意图为:
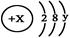 且X、Y 均为不大于20的正整数,据此回答下列问题:
且X、Y 均为不大于20的正整数,据此回答下列问题:
(1)若该微粒一般情况下不与其它元素的原子反应,这种微粒的符号是;
(2)若该微粒有很强的非金属性,且只需得到一个电子就能达到稳定结构,这种微粒的结构示意图为。
(3)若该微粒为一价阳离子,且对应的碱为可溶性强碱,则x= ,y=。