研究化学反应原理对生产生活很有意义,请用化学反应原理的相关知识回答下列问题: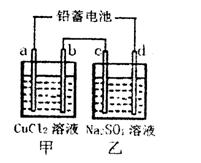
(1)用铅蓄电池电解甲、乙两电解池中的溶液。已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)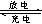 2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是______
2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是______ ______
______
(填写序号)
| A.d极为阴极 |
| B.若利用甲池精炼铜,b极应为粗铜 |
| C.放电时铅蓄电池负极的电极反应式为: PbO2(s)+4H+(aq)+ 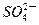 (aq)+4e- (aq)+4e- PbSO4(s)+2H2O(1) PbSO4(s)+2H2O(1) |
| D.若四个电极材料均为石墨,当析出6.4g Cu时,两池中共产生气体3.36L(标准 |
状况下)
(2)某二元酸H2A在水中的电离方程式是:H2A=H++HA-;HA- H++A2-,请回答下列问题:
H++A2-,请回答下列问题:
①Na2A溶液显_________(填“酸性”、“中性”或“碱性”),理由是________________
(用离子方程式表示)。
②已知0.1 mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.
mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.
(3)二甲醚是一种重要的清洁燃料,利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g); △H=-90.8kJ·mol-1
CH3OH(g); △H=-90.8kJ·mol-1
②2 CH3OH(g)
CH3OH(g) CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g);△=-41.3kJ·mol-1
CO2(g)+H2(g);△=-41.3kJ·mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式___________________.
(4)SO2是硫酸生产的重要中间产物,也是空气污染的主要原因之一,其氧化生成SO3的反应为:2SO2(g)+O2(g) 2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
下列物质中: ①Na ②蔗糖 ③CO ④AgCl ⑤CO2 ⑥NaCl溶液 ⑦NH3 ⑧H2S ⑨H2SO4 ⑩Ba(OH)2
属于电解质的是 ;属于强电解质的是 ;
属于非电解质的是 ;能导电的是 ;
属于酸性氧化物的是 ;
(1)按要求写出下列反应的离子方程式
①少量二氧化碳通入澄清石灰水
②硫酸氢钠与过量氢氧化钡溶液混合
③熔融状态下NaHSO4电离方程式
(2)①用双线桥表示下列氧化还原反应电子转移
2KMnO4 + 16HCl(浓)=" 2KCl" + 2MnCl2 + 5Cl2↑+ 8H2O
②配平下列氧化还原反应方程式:
___KMnO4+___H2O2+__H2SO4 —__K2SO4+__MnSO4+__ O2↑+__H2O
Ⅰ、现有A g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子的个数为________________个。
(2)该气体在标准状况下的密度为_______________ g/L。
(3)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________________mol/L。
Ⅱ、已知食盐常加人KIO3来补充碘元素,检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4 3K2SO4+3I2+3H2O
3K2SO4+3I2+3H2O
(1)如果反应中转移0.2mol电子,则生成I2的物质的量为 mol。
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)
若反应中消耗Cl2 1.5 mol,则被氧化的NH3在标准状况下的体积为______ L。
用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,测得溶液pH变化如右图所示。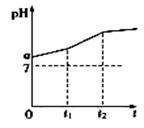
(1)在0→t1时间内,阳极上的电极反应式为:___________________________;
(2)用离子方程式表示:a点 pH﹥7原因:__________________________;0→t1时间内,溶液pH升高比较缓慢的原因:_______________________
(3)从原溶液中溶质变化角度看,t1时刻的意义是________________________
(4)有人利用电解原理开发出了一种家用“84”消毒液(有效成分为NaClO)发生器(构造如图),在制备该消毒液时,a电极应该连接在电源的________________极上,若两个电极一种是铁、一种是石墨,则b极材料是________________。
请按要求回答下列问题:
(1)将100mL 0.3mol·L-1的NaHSO4溶液和100mL 0.2mol·L-1的Ba(OH)2溶液充分混合,写出所发生反应的离子方程式:____________________________;
若向反应后的溶液中滴加2-3滴酚酞试液,则溶液的颜色变为__________________;
(2)某温度时,水的离子积常数KW=10-13,将此温度下pH=11的Ba(OH)2溶液aL与pH=1的H2SO4溶液bL混合,设混合溶液体积为两者之和,所得固体体积忽略不计。若所得混合溶液为中性,则a:b=_________________
(3)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10-10,Ksp(AgY)=1.0×10-12,Ksp(AgZ)=8.7×10-17。则AgX、AgY、AgZ三者的溶解度(mol/L)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:____________________________;若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)________(填“增大”“减小”或“不变”)。