金属钛被称为铁和铝之后崛起的“第三金属”,常见化合价为+4。它是空间技术、航海、化工、医疗上不可缺少的材料。
Ⅰ.工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程如下图(部分产物略去):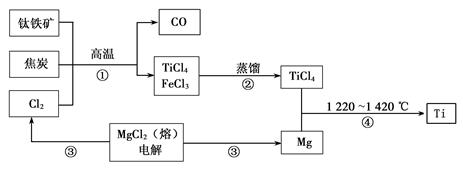
(1)步骤①反应的化学方程式为:2FeTiO3 + 6C + 7Cl2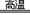 2FeCl3 + 2TiCl4 + 6CO,还原剂是 。
2FeCl3 + 2TiCl4 + 6CO,还原剂是 。
(2)步骤②分离出TiCl4的方法,利用了TiCl4与FeCl3 的不同。
(3)步骤④反应的化学方程式为________________________________,该反应在氩气中进行的理由是________________________ ______。
(4)绿色化学提倡物料循环。以上流程中,可用于循环的物质除Cl2、Mg外,还有____________。
II. 工业上也可用TiO2通过下述两种方法制备金属钛:
方法一:先将TiO2氯化为TiCl4,再还原得到Ti。
(5)氯化反应TiO2 (s ) +2Cl2 (g)
) +2Cl2 (g)  TiCl4(l) + O2 (g) 无法自发正向进行,在反应器中加入碳,则在高温条件下反应可顺利进行。试从化学平衡角度解释,往氯化反应器中加碳的原因: 。
TiCl4(l) + O2 (g) 无法自发正向进行,在反应器中加入碳,则在高温条件下反应可顺利进行。试从化学平衡角度解释,往氯化反应器中加碳的原因: 。
方法二:以熔融盐为电解液电解TiO2获得Ti。其中,碳块为阳极,电极反应式为:2O2ˉ– 4eˉ=O2↑;TiO2作阴极,被还原。
(6)阴极的电极反应式为 。
(7)电解过程中需定期向电解槽中加入碳块的原因是 。
A、B、C、D、E为原子序数依次增大的前36号元素,其中A与D、B与C同主族,D与E同周期。A为原子半径最小的元素,B的最外层电子数是次外层电子数的3倍,E的原子序数是B和C两元素原子序数之和。回答下列问题:
(1)D元素的原子结构示意图为,E元素的电子排布式为 。
。
(2)A2B2能以任意比例与水互溶,请推测其主要原 因是,A2B2分子是否为手性分子(填“是”或“否”)。
因是,A2B2分子是否为手性分子(填“是”或“否”)。
(3)E的原子半径为r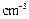 ,摩尔质量为
,摩尔质量为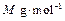 ,阿伏伽德罗常数值为
,阿伏伽德罗常数值为 ,E单质晶体中原子的空间利用率为68%,则E单质晶体中E原子的配位数为,其晶体密度为
,E单质晶体中原子的空间利用率为68%,则E单质晶体中E原子的配位数为,其晶体密度为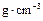 。
。
A、B、C、D、E为原子序数依次增大的短周期主族元素。已知A、B、C同周期,B、D同主族,且D的原子序数是B的2倍。回答下列问题:
(1)DC2分子的空间构型为,其中心原子采取杂化。
(2)DB2是(填“极性”或“非极性”)分子,其在水中的溶解度较大,其原因除了其分子的极性因素以外,另一原因是。
(3)若A是其所在周期元素中核外单电子数最多的元素,则+3价A的含氧酸、D及E的最高价含氧酸 三者酸性由强到弱的顺序为(用酸的分子式作答);若A是所在周期原子半径最大的元素,则单质A与O2点燃的化学方程式为。
三者酸性由强到弱的顺序为(用酸的分子式作答);若A是所在周期原子半径最大的元素,则单质A与O2点燃的化学方程式为。
A、B、C、D、E为主族元素。A、B、C 同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素的最外层电子数为次外层电子数的两倍,B的氢化物可与它的最高价氧化物的水化物反应生成盐。D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元素。试回答下列问题:
同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素的最外层电子数为次外层电子数的两倍,B的氢化物可与它的最高价氧化物的水化物反应生成盐。D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元素。试回答下列问题:
(1)C元素简单离子的电子排布图是。
(2)A、B两元素各有多种氢化物,其电子数为10的氢化物中沸点较高的是(填化学式)。
(3)B与E可形成离子化合物BE5,其阴离子的电子式是,BE5含有的化学键类型有 (选填代号:A.离子键 B.极性键 C.非极性键 D.配位键)。
(选填代号:A.离子键 B.极性键 C.非极性键 D.配位键)。
(4)下列晶体结构示意图中(●代表阳离子,○代表阴离子),能表示C与D形成的离子化合物的晶体结构的是(选填字母标号“a”或“b”)。
A、B、C、D、E、F六种物质的相互转化关系如右图所示。图中反应条件均未标出,部分产物(包括水)已略去,反应①是置换反应。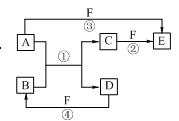
(1)若B、C、F都是气态单质,且B为黄绿色有毒气体。③和④两个反应中都有水生成,反应②需要放电才能发生。A、D均为极易溶于水的气态氢化物,且相遇有白烟生成。则A分子的立体构型为,反应③的化学方程式为 。
。
(2)若A、D为短周期元素的单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍。F是一种含氧酸,③和④两个反应中都有红棕色气体生成。则E的化学式为
 ,反应④的化学方程式为。
,反应④的化学方程式为。
按要求回答下列问题:
(1)已知在200℃,101kPa时,H2与碘蒸气作用生成1mol HI放出7.45kJ热量,则该反应的热化学方程式为。
(2)太阳能的开发和利用是21世纪一个重要课题。利用储能介质储存太阳能的原理是:白天在太阳照射下使某种盐熔化,吸收热量,晚间熔盐固化释放出相应能量。已知下列数据:
| 序号 |
盐 |
熔点/℃ |
熔化热/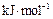 |
参考价格/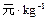 |
| ① |
CaCl2·6H2O |
29.0 |
37.3 |
780~850 |
| ② |
Na2SO4·10H2O |
32.4 |
77.0 |
800~900 |
| ③ |
Na2HPO4·12H2O |
36.1 |
100.1 |
1800~2400 |
| ④ |
Na2SiO3·5H2O |
52.5 |
49.7 |
1400~1800 |
其中最适宜作为储能介质的是。(选填物质序号)
(3)离子晶体晶格能的定义是气态离子形成1mol离子晶体释放的能量,通常取正值。现已知: