Ⅰ. 金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:
金属铝的生产是以Al2O3为原料,在熔融状态下进行电解: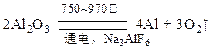
请回答下列问题: (1)冰晶石(Na3AlF6)的作用是 。
(1)冰晶石(Na3AlF6)的作用是 。 (2)电解生成的金属铝是在熔融液的 (填“上层”或“下层”)。
(2)电解生成的金属铝是在熔融液的 (填“上层”或“下层”)。 (3)电解时所消耗的电极是 (填“阳极”或“阴极”)。
(3)电解时所消耗的电极是 (填“阳极”或“阴极”)。 (4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成 (填代号)。
(4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成 (填代号)。 a.冰晶石 b.氧化铝 c.铝锭 d.硫酸铝
a.冰晶石 b.氧化铝 c.铝锭 d.硫酸铝
Ⅱ.钢铁工业对促进经济和社会发展起了重要作用。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在_________部分发生反应
(2)炼钢时,除磷的化学方程式为_________;加入硅、锰和铝的目的是_______。
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹_______(填“前”或“后”)加入,
原因是_____________。
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是_________。从环保和经济角度考虑,上述尾气经处理可用作________。
1773年,伊莱尔·罗埃尔(Hilaire Rouelle)发现尿素。1828年,弗里德里希·维勒首次使用无机物质氰酸钾[KCNO]与硫酸铵人工合成了尿素[CO(NH2)2]。
(1)维勒合成尿素的化学反应方程式为。
(2)工业上尿素是由CO2和NH3在一定条件下合成,其反应方程式为当氨碳比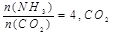 的转化率随时间的变化关系如图1所示。
的转化率随时间的变化关系如图1所示。
①A点速率v逆(CO2)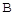 点速率为V正(CO2)(填“大于”、“小于”或“等于”)
点速率为V正(CO2)(填“大于”、“小于”或“等于”)
②NH3的平衡转化率为。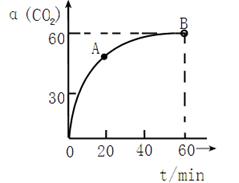
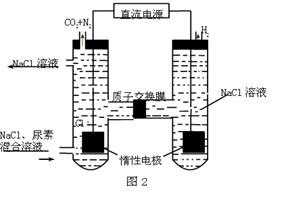
(3)人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图2。
①电源的负极为(填“A”或“B”)。
②阴极室中发生的电极反应式为
③电解结束后,阴极室溶液的pH与电解前相比将(填“增大”、“减小”、“不变”)若两极共收集到气体11.2L(标准状况),则除去的尿素为g(忽略气体的溶解)。
工业上采用的一种污水处理方法是:保持污水的pH在5.0-6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。某科研小组用此法处理污水,设计装置示意图,如图所示。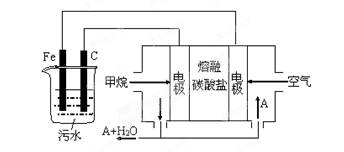
⑴实验时若污水中离子浓度较小,导电能力较差,无法使悬浮物形成浮渣。此时,应向污水中加入适量的__________。
a.BaSO4 b.CH3CH2OH c.Na2SO4 d.NaOH
⑵电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:
Ⅰ._____________________________;Ⅱ.______________________________。
⑶电极反应Ⅰ和Ⅱ的生成物反应得到Fe(OH)3沉淀的离子方程式是____________________。
⑷该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是_________________;
铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子),如Fe3O4可表示为FeO·Fe2O3,制备流程为: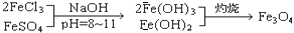
根据题意回答:
(1)现称取2.8 g铁粉,加入一定量的稀硫酸使其完全溶解后,再加入g的FeCl3固体,经上述反应后,方可得到纯净的Fe3O4;
(2)如果以MgSO4和FeCl3为原料,要获得18.0克MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH溶液mL;
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取一定量该产品溶于足量盐酸中,还需通入标准状况下672 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液蒸干,灼烧至恒重,得9.6 g固体。该产品的化学式为;
(4)有一种在电子工业上应用广泛的含铬铁氧体,其组成可表示为: ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为。
下图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,D是应用最广泛的金属。根据图示回答问题: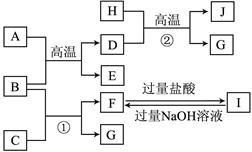
(1)反应②的化学方程式是;
(2)J与氢碘酸反应的离子方程式是;
(3)要使溶液F中的一种金属元素全部以沉淀的形式析出,最适宜加入的反应物是(填化学式);I→F的离子方程式为。
(1)完成并配平白磷和氯酸溶液反应的化学方程式:
P4 + HClO3 + → HCl + H3PO4
(2)白磷有毒,在实验室可采用CuSO4溶液进行处理,其反应为:
11P4 + 60CuSO4 + 96H2O → 20Cu3P + 24H3PO4 + 60H2SO4
该反应的氧化产物是,若有1.1 mol P4反应,则有mol电子转移;
(3)磷的一种化合物叫亚磷酸(H3PO3)。
已知:⑴0.1 mol/L H3PO3溶液的pH = 1.7;
⑵H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;⑶H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。关于H3PO3的说法:①强酸;②弱酸;
③二元酸;④三元酸;⑤氧化性酸;⑥还原性酸,其中正确的是。
| A.②④⑥ | B.②③⑥ | C.①④⑤ | D.②③⑤ |