以下物质;(1) 甲烷;(2) 苯;(3) 聚乙烯;(4) 苯乙烯;(5) 2-丁炔;(6) 环己烷;(7) 邻二甲苯。既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是:
| A.(3) (4) (5) | B.(4) (5) | C.(4) (5) (7) | D.(3) (4) (5) (7) |
有X、Y、Z、W、M五种原子序数增大的短周期元素,其中X、M同主族; Z+与Y2-具有相同的电子层结构,W是地壳中含量最多的金属,X与W的原子序数之和等于Y与Z的原子序数之和;下列序数不正确的是
| A.离子半径大小:r(Y2-)>r(W3+) |
| B.W的氧化物对应的水化物可与Z的最高价氧化物水化物反应 |
| C.X有多种同素异形体,而Y不存在同素异形体 |
| D.X、M均能与氯形成由极性键构成的正四面体非极性分子 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.1mol[Ag (NH3)2]OH配合物中含有9NA个σ键 |
| B.标准状况下,22.4L C2H6O中含C-H键5NA |
| C.1mol冰醋酸和lmol乙醇在加热和浓硫酸条件下充分反应生成的水分子数为NA |
| D.KClO3+6HCl ===KCl+3Cl2↑+3H2O反应中,生成71g Cl2时,转移的电子数目为2NA |
能正确表示下列反应的离子方程式是
A.Na2O2加入水制备O2:2O +2H2O=4OH-+O2↑ +2H2O=4OH-+O2↑ |
B.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO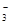 =Ag++NO↑+H2O =Ag++NO↑+H2O |
C.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO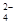 =BaSO4↓+2H2O =BaSO4↓+2H2O |
D.向苯酚钠溶液中通入少量CO2:2C6H5O-+ CO2 + H2O  2C6H5OH + CO 2C6H5OH + CO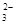 |
下列有关物质分类正确的是
| A.液氯、冰水混合均为纯净物 |
| B.NO2、CO、CO2均为酸性氧化物 |
C. 与 与 互为同系物 互为同系物 |
| D.淀粉、纤维素和油脂都属于天然高分子化合物 |
下列有关化学与生活说法中,不正确的是
A. 是世界通用的循环再生标志,简称回收标志 是世界通用的循环再生标志,简称回收标志 |
| B.大量生产聚乙烯、聚氯乙烯一次性超薄袋,方便日常生活 |
| C.75%的乙醇溶液常用来消毒,是因为酒精能够使细菌蛋白质发生变性 |
| D.页岩气是从页岩层中开采出来的天然气。由于产气的页岩分布广、厚度大,且普遍含气,故可以成为新的化石燃料来源 |