下列热化学方程式中,正确的是: ( )
| A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ·mol-1 |
| B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g) 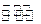 2NH3(g)△H=-38.6 kJ·mol-1 2NH3(g)△H=-38.6 kJ·mol-1 |
| C.HCl和NaOH反应的中和热△H="-57.3" kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热 △H=2×(-57.3)kJ·mol-1 |
| D.在101 kPa时,2gH2完全燃烧生成液态水,放出285.8lkJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ·mol-1 |
把70%的HNO 溶液(密度为1.40 g·cm-3)加到等体积水中,稀释后HNO3溶液中溶质的质量分数是()
溶液(密度为1.40 g·cm-3)加到等体积水中,稀释后HNO3溶液中溶质的质量分数是()
| A.="0.35" | B.<0.35 |
| C.>0.35 | D.≤0.35 |
密度为ρ g·cm-3的溶液b mL,含有相对分子质量为Mr的溶质a g,其物质的量浓度为cb mol·L-1,质量分数为W。则下列关系式不正确的是( )
A.cB= mol·L-1 mol·L-1 |
B.a="ρ·b·w" g |
C.ρ=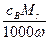 g·cm-3 g·cm-3 |
D.w=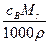 % % |
20 ℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0 mol·L-1,则下列说法中不正确的是()
| A.25 ℃时,饱和KCl溶液的浓度大于4.0 mol·L-1 |
B.此溶液中KCl的质量分数为 ×100% ×100% |
| C.20 ℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液 |
| D.将此溶液蒸发部分水,再恢复到20 ℃时,溶液密度一定大于1.174 g·cm-3 |
实验室常用98%(密度为1.84 g·mL-1)的浓硫酸配制1∶4的稀硫酸,此稀硫酸的密度为1.23 g·mL-1,则其物质的量浓度为( )
| A.4.6 mol·L-1 | B.5.7 mol·L-1 |
| C.3.88 mol·L-1 | D.18.4 mol·L-1 |
体积相同的某营养液两份,其配方如下:
| KCl |
K2SO4 |
ZnSO4 |
ZnCl2 |
|
| (1) |
0.3 mol |
0.2 mol |
0.1 mol |
— |
| (2) |
0.1 mol |
0.3 mol |
— |
0.1 mol |
两份营养液中各离子浓度()
| A.完全相同 | B.完全不同 |
| C.仅c(K+)相同 | D.仅c(Cl-)相同 |