已知A、B、C、D、E、F都是周期表中前四周期的元素。它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出C原子的价层电子排布图 ,F位于周期表 区。
(2)A、B、C的第一电离能由小到大的顺序为 。(写元素符号)
(3)F和质子数为25的M的部分电离能数据列于下表
| 元素 |
M |
F |
|
| 电离能(kJ·mol-1) |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释是 。
(4)晶胞中F原子的配位数为 ,若F原子的半径为rcm,则F晶体的密度为 (用含r的表达式表示),该晶胞中原子空间利用率为 。
(5)H2S和C元素的氢化物(分子式为H2C2的主要物理性质比较如下
| |
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
| H2S |
187 |
202 |
2.6 |
| H2C2 |
272 |
423 |
比任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因 。
(1)根据下列几种粒子的结构示意图,回答问题: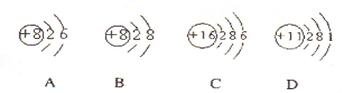
①其中属于阴离子的是 ,属于金属元素的是 。(填编号)
②试写出A、C、D三种元素形成的一种化合物在水溶液中的电离方程式:。
(2)已知氢元素有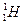 、
、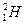 、
、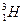 三种核素,氧
三种核素,氧 元素也有
元素也有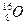 、
、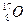 、
、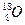 三种核素,则它们所形成的水分子共有种。
三种核素,则它们所形成的水分子共有种。
(3)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下: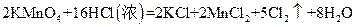
①在该反应中,氧化剂是,还原剂是 。
②当有0.20 mol电子发生转移时,生成氯气的体积为L(标准状况)
有以下几种物质①干燥的氯化钠晶体②液态氯化氢③三氧化硫气体 ④蔗糖固体⑤乙醇 ⑥金属铜 ⑦熔融的氢氧化钠 ⑧硝酸钾溶液 ⑨除去灰尘的空气。
填空回答:(填序号)
(1)在①~⑥物质中构成的微粒只能在固定位置上振动的是 ;
(2)在①~⑨物质中属于电解质的是 ;
(3)在①~⑦物质中溶于水后的溶液能够导电的是 。
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家。
⑴下图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答: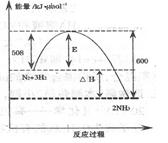
对于合成氨的反应下列说法正确的是(填编号)。
A.该反应在任意条件下都可以自发进行
B.加入催化剂,能使该反应的E和△H都减小
C.若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1>K2
D.该反应属于人工固氮
⑵现在普遍应用的工业合成氨的方法为N2+3H2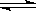 2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。
2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措 施是。
施是。
A.使用的更高效催化剂 B.升高温度
B.升高温度
C.及时分离出氨气 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生N2+3H22NH3的反应,下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=。
从11min起,压缩容器的体积为1L,则n(N2)的变化曲线为。
A. a B.b C.c D.d
⑶随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通人一个加热到500℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质里,用吸附在它内外表面上的金属钯多晶薄膜作电极,实现了常压、570℃条件下高转化率的电解法合成氮(装置如上图)。则电解池阴极上的电极反应式是
;四只试剂瓶中分别盛装有NaNO 溶液、Na
溶液、Na CO
CO 溶液、Na
溶液、Na SO
SO 溶液和NaCl溶液,就如何检验这四种溶液分别回答下列各题:
溶液和NaCl溶液,就如何检验这四种溶液分别回答下列各题:
在 四支试管中分别取四种溶液各1mL,做下列实验。
四支试管中分别取四种溶液各1mL,做下列实验。
(1)在四支试管中分别滴入(填试剂名称),检验出的物质是,发生反应的化学方程式是
(2)在剩余三支试管中分别滴入(填试剂的化学式),检验出的物质是,发生反应的离子方程式是
(3)在剩余两支试管中分别滴入(填试剂的化学式),检验出的物质是
以下是某课题组设计的合成聚酯类高分子材料
 的路线:
的路线: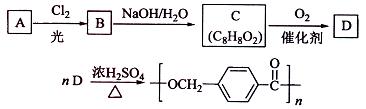
已知:
① A的相对分子质量小于110,其中碳的质量分数约为0.906;
②同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:
③C可发生银镜反应。
请根据以上信息回答下列问题:
(1)A的分子式为;
(2)由A生成B的化学方程式为,
反应类型是;
(3)由B生成C的化学方程式为,
该反应过程中生成的不稳定中间体的结构简式应是;
(4)D的结构简式为,
(5)写出符合下列条件的D的所有同分异构体的结构简式:
①含有苯环;②水解产物之一为乙酸。