设NA为阿伏加德罗常数的值,下列有关说法正确的是
| A.28克C2H4所含共用电子对数目为4NA |
| B.1mol甲基所含电子总数为9 NA |
| C.标准状况下,11.2L己烷所含分子数为0.5 NA |
| D.汽油、煤油、柴油和植物油都是碳氢化合物 |
根据碘与氢气反应的热化学方程式
(i)I2(g)+ H2(g)  2HI(g)ΔH ="-9.48" kJ·mol-1
2HI(g)ΔH ="-9.48" kJ·mol-1
(ii) I2(S)+ H2(g) 2HI(g)ΔH ="+26.48" kJ·mol-1下列判断正确的是( )
2HI(g)ΔH ="+26.48" kJ·mol-1下列判断正确的是( )
| A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(i)的产物比反应(ii)的产物稳定 |
| D.反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
下列说法正确的是( )
| A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 |
| B.同温同压下,H2 (g)+Cl2(g)= 2HCl(g)在光照和点燃条件下的△H不同 |
| C.已知:①2H2(g) +O2(g) =2H2O(g) △H="-a" kJ·mol-1, ②2H2(g)+O2 (g)= 2H2O(1)△H="-b" kJ·mol-1,则a>b |
| D.已知:①C(s,石墨)+O2 (g)=CO2(g)△H="-" 393.5kJ·mol-1, |
②C(s,金刚石)+O2(g)=CO2 (g)△H="-" 395.0 kJ·mol-1,
则C(s,石墨)=C(s,金刚石)△H=" +" 1.5 kJ·mol-1。
已知:CO2(g) + 3H2(g) 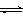 CH3OH(g) + H2O(g)ΔH =-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )
CH3OH(g) + H2O(g)ΔH =-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )
A.升高温度能使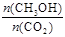 增大 增大 |
| B.反应达到平衡状态时,CO2的平衡转化率为75% |
| C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1 |
下列说法错误的是( )
| A.NH4NO3溶于水吸热,说明其溶于水不是自发过程 |
| B.同一种物质气态熵值最大,液态时次之,而固态时熵值最小 |
| C.不借助于外力能自发进行的过程,其体系的能量趋向于从高能状态转变为低能状态 |
| D.由焓判据和熵判据组合而成的复合判据,更适合于所有的过程 |
物质的水溶液能导电,且该物质是非电解质,溶于水时化学键被破坏的是( )
| A.液溴 | B.干冰 | C.蔗糖 | D.硫酸钡 |