下列排列顺序不正确的是
| A.粒子半径:Al3+ < Mg2+ < F- |
| B.热稳定性:HI > HBr > HCl > HF |
| C.酸性: H2SiO3< H3PO4< H2SO4< HClO4 |
| D.碱性: NaOH > Mg(OH)2> Al(OH)3 |
关于镀铜和电解精炼铜,下列说法中正确的是 ( )
| A.都用粗铜做阳极、纯铜做阴极 | B.电解液的成分都保持不变 |
| C.阳极反应都只有Cu-2e-=Cu2+ | D.阴极反应都只有Cu2++2e—=Cu |
下列4种装置工作一段时间后,测得导线上均通过了0.002 mol 电子,此时溶液的pH值由大到小的排列顺序为(不考虑盐的水解和溶液体积变化)①盛100 mL CuSO4 ②盛200 mL 0.01 mol·L-1 H2SO4 ③盛200 mL ZnCl2 ④盛200 mL NaCl饱和溶液()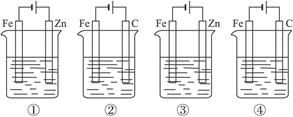
| A.④②③① | B.④③②① | C.④③①② | D.④①③② |
实验室用铅蓄电池进行电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极为Pb+ ====PbSO4+2e-,正极为PbO2+4H++
====PbSO4+2e-,正极为PbO2+4H++ +2e-====PbSO4+2H2O,今若制得Cl2 0.025 mol,这时电池内消耗的H2SO4的物质的量至少是()
+2e-====PbSO4+2H2O,今若制得Cl2 0.025 mol,这时电池内消耗的H2SO4的物质的量至少是()
| A.0.025 mol | B.0.050 mol | C.0.10 mol | D.0.20 mol |
下列情况下,能使反应Cu+Zn2+===Cu2++Zn发生的是( )
| A.铜片作原电池的负极,碳棒作原电池的正极,氯化锌作电解质溶液 |
| B.铜锌合金在潮湿空气中发生电化学腐蚀 |
| C.用锌片作阴、阳电极,电解硫酸铜溶液 |
| D.用铜片作阴、阳电极,电解硫酸锌溶液 |
相同温度时,下列两个反应的反应热分别用ΔH1和ΔH2表示,则()
①H2(g)+ O2(g)====H2O(g) ΔH1=-Q1 kJ·mol-1
O2(g)====H2O(g) ΔH1=-Q1 kJ·mol-1
②2H2O(l)====2H2(g)+O2(g)ΔH2=+Q2 kJ·mol-1
| A.Q1>Q2 | B.Q1=Q2 | C.2Q1<Q2 | D. Q2=Q1 Q2=Q1 |