硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下: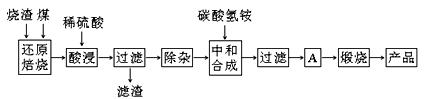
(1)在“还原焙烧”中产生的有毒气体可能有 。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示: 。
(3)根据下表数据:
| 氢氧化物 |
Al(OH)3 |
Mg(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀的pH |
3.10 |
8.54 |
2.01 |
7.11 |
| 完全沉淀的pH |
4.77 |
11.04 |
3.68 |
9.61 |
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于 ,当pH=5时,溶液中c(Al3+)为 mol·L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33)。
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为 。
若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是 。
(5)A的操作是 。
(6)m g烧渣经过上述工艺可得红氧化铁n g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于 (用含m、n的表达式表示)。
(共8分)A、B、C、D、E、F六种物质的相互转化关系如下图所示,其中反应①是置换反应。
一.若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行。写出②的离子方程式:_____________________________
二.若A为金属单质,D为非金属单质,且所含元素的原子序数A是D的2倍,原子核外最外层电子数D是A的2倍,③④反应中都有红棕色气体生成,②③④反应中的部分产物已略去。写出①的化学方程式:____写出④的化学方程式:
____ __;在②③④反应中F既表现氧化性又表现酸性的是(填序号)__ ______。
(共6分)A、B、C是中学化学常见的三种有色物质(其组成元素的核电荷数均小于18),其摩尔质量依次减小,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂。请写出A、B、C分别与水反应的离子方程式。
⑴ A与H2O __________________________________。
⑵ B与H2O _________________________________。
⑶ C与H2O __________________________________。
(共14分)
(1)下列操作错误的是_________(填序号)
A. 用蒸发皿进行加热蒸发实验时,不垫石棉网。
B. 浓硫酸不慎沾到皮肤上,迅速用NaOH溶液清洗,再用水洗。
C. 蒸馏时,将温度计水银球插入液面以下。
D. 闻气体气味时,用手在容器口轻轻扇动,使少量气体飘入鼻孔中。
E. 使用分液漏斗和容量瓶时,首先检查是否漏液。
(2) 最近媒体报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84
消毒液”(有效成分是NaClO)发生氯气中毒的事件。根据你所学的氧化还原反应知识,用
离子方程式表示产生氯气的原因:
(3) 已知向偏铝酸钠溶液中加入稀盐酸有氢氧化铝生成。某同学根据所学知识,提出不能使用该方法制取A1(OH)3,理由为。(用离子方程式表示)请你另举出一种用氯化铝溶液制取A1(OH)3的合理方法,该反应的离子方程式为。
(4)据有关报道。目前已能冶炼出纯度高达99.9999%的铁,下列关于纯铁的叙述中,正确的是(填字母)。
A.硬度比钢小,熔点比钢高 B.不能与盐酸反应
C.与不锈钢成分相同 D.在冷的浓硫酸中钝化
(5)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色时停止加热,所得分散系的分散质大小范围是。
(6)合成氨工业生产中常用铁触媒做催化剂,其主要成分是FeO、Fe2O3。已知某铁触媒中,铁、氧离子的物质的量之比为4∶5,其中Fe2+与Fe3+物质的量之比为。
苄佐卡因是一种医用麻醉药品,学名对氨基苯甲酸乙酯,它以对硝基甲苯为主要起始原料经下列反应制得: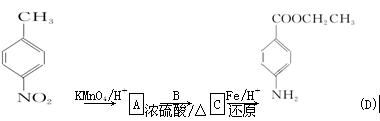
请回答下列问题:
(1)写出A、B、C的结构简式:A________、B________、C________。
(2)用核磁共振谱可以证明化合物C中有________种氢原子处于不同的化学环境。
(3)写出同时符合下列要求的化合物C的所有同分异构体的结构简式(E、F、G除外)
①化合物是1,4-二取代苯,其中苯环上的一个取代基是硝基
②分子中含有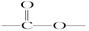 结构的基团
结构的基团
注:E、F、G结构如下: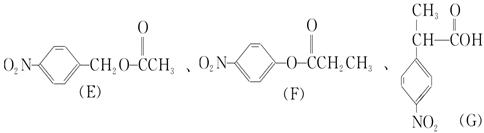
________________________________________________________________________。
(4)E、F、G中有一化合物经酸性水解,其中的一种产物能与FeCl3溶液发生显色反应,写出该水解反应的化学方程式。
(5)苄佐卡因(D)的水解反应如下: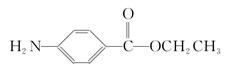 +C2H5OH
+C2H5OH
化合物H经聚合反应可制成高分子纤维,广泛用于通讯、导弹、宇航等领域。
请写出该聚合反应的化学方程式
__________________________。
由丙烯经下列反应可得到F和高分子化合物G,它们都是常用的塑料。
请回答下列问题:
(1)F的分子式为________,化合物E中所含两个官能团的名称是、。
(2)写出下列反应过程的反应类型:丙烯直接形成高分子;A→B。
(3)1molA与NaOH的醇溶液反应(生成物仍为卤代烃)的化学方程式为:
;
B转化为C的化学方程式为_____________________________________________。
(4)E的一种同分异构体M具有如下性质:①能发生银镜反应;②1mol M与足量的金属钠反应可产生1mol H2,则M的结构简式为_________ ____。(注:两个羟基连在同一碳上的结构不稳定)