下列各个装置中能组成原电池的是
下列实验装置及操作正确的是
下列各表述与示意图一致的是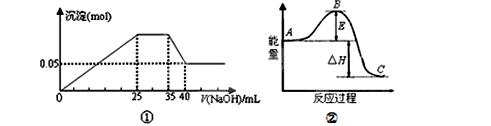
| A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:3:2 |
| B.图①中使用的NaOH的浓度为2 mol·L-1 |
| C.图②中物质A反应生成物质C,△H>0 |
| D.图②中曲线表示某反应过程的能量变化,若使用催化剂,E值会减小 |
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声同时产生白色烟雾。撞击时发生的化学方程式为:5KClO3+6P=3P2O5+5KCl,下列有关叙述正确的是
| A.上述反应中氧化剂和还原剂的物质的量之比为6:5 |
| B.上述反应中消耗62gP时,转移电子的物质的量为15mol |
| C.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中 的水分,生成磷酸小液滴(雾) |
D.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以 用白磷代替 用白磷代替 |
甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙十丁→沉淀;乙+丁→无色无味气体。则甲、乙、丙、丁四种溶液依次是
| A.BaCl2 Na2CO3 AgNO3盐酸 | B.BaCl2 Na2CO3盐酸 AgNO3 |
| C.Na2CO3盐酸 AgNO3 BaCl2 | D.AgNO3盐酸 BaCl2 Na2CO3 |
把3体积的NO2气体,依次通过下列3个分别装有①NaHCO3饱和溶液,②浓H2SO4,③Na2O2的装置后,用排水法把残留气体收集到集气瓶中,集气瓶内气体应是(同温同压下测定)
| A.1体积NO | B.2体积NO2和0.5体积O2 |
| C.2体积O2 | D.0.25体积O2 |