铁、铜是我们生活中重要的金属材料。
(1)将油漆涂在铁艺家具上防止生锈,其目的是将铁与空气中的 隔绝。
(2)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,发生的化学方程式为 。
(3)矿物的储量有限,而且不可再生,我们必须保护金属资源并进行金属的回收利用。欲从含有硫酸、硫酸亚铁和硫酸铜的废液中,回收全部铜。处理过程如下:
步骤①加入过量铁粉,发生的反应方程式为: , 。充分反应后步骤②进行的操作是 ,得到的滤渣中含有 ,继续处理可以得到纯净的金属铜和硫酸亚铁固体。
地球是一颗蓝色的星球,表面大部分被海洋覆盖,海水中蕴含的元素多达80多种。通过海水晒制可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。以下是一种制备精盐的实验方案,步骤如下: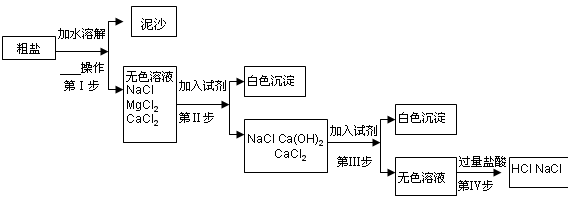
回答下列问题:
(1)小星对粗盐进行初步提纯第Ⅰ步进行操作。
(2)小明在第Ⅱ步中,欲将MgCl2去除,选择添加NaOH溶液,请写出该反应的化学方程式。但小亮同学对小明设想提出不同意见,他认为应该用Ca(OH)2代替NaOH,理由是。
(3)小琴对第Ⅲ步进行实验,要将溶液中的Ca2+沉淀出来,必然加一种常见的盐,该盐为,反应化学方程式为,该盐要加过量的目的是,据此分析,经过第Ⅲ步除去不溶物后,所得溶液的所有溶质有 。
(4)第Ⅳ步中,小琴加入过量盐酸,除去溶液中所有杂质后,认为过量的盐酸也并不是新引入的杂质,经过加热蒸发,盐酸也可以除去,小琴利用了盐酸的
性。
通过一年的化学学习,你已经掌握了实验室制取气体的有关规律,请你结合下列装置图回答问题。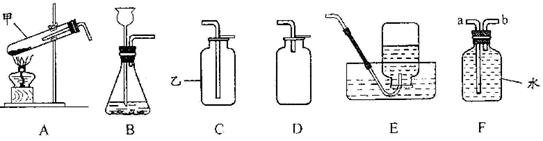
(1)指出仪器名称:甲,乙。
(2)如果用A装置加热氯酸钾固体制取氧气,请指出其中的两处错误:
①;
②;
加热氯酸钾制取氧气的化学方程式为。
(3)用B装置制CO2时,反应的化学方程式为,
收集CO2应选用的装置是(填序号)。
(4)如果某同学用F装置收集尾气一氧化碳(有毒),则收集时气体应从导管口的端(填“a”或“b”)通入。
某混合气体中可能含有氢气、一氧化碳、二氧化碳、氯化氢、氨气和水蒸气中的两种或几种,将混合气体依次通过:澄清石灰水(无浑浊现象)→氢氧化钡溶液(有浑浊现象)→浓硫酸(无明显现象)→灼热氧化铜(固体变红)→无水硫酸铜(固体变蓝)。
则混合气体中一定含有的成分是。
废旧干电池中许多物质是可以回收利用的。某种型号干电池的剖面如图所示。请回答下列问题: 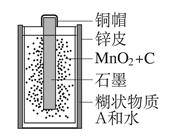
(1)干电池的铜帽和锌皮,属于材料(选填“有机合成”或“金属”);
(2)取糊状物质A,溶于水后,取滤液,分为两份,一份加入烧碱溶液,加热产生一种刺激性气味的气体,该气体的水溶液pH>7,且常用作化肥,则该气体为;另一份加入AgNO3溶液,产生白色沉淀,滴加稀HNO3沉淀不溶解,则可推知A物质的化学式为 。
已知有如下反应:A + B ="=" C + D (答题时需注明必要的反应条件)
(1)若A为CO2,D为H2O,则反应的化学方程式为;
(2)若反应为A+2NaOH==2C+Cu(OH)2 ↓,则A的化学式可能为(写一种)。