我国属于海洋大国,浩瀚的海域蕴藏着丰富的化学资源。
(1)海底蕴藏着大量的煤、 、天然气等常规化石燃料。
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃料。燃烧反应前后分子种类变化的微观示意图如下所示。
1个B分子中含有 个原子。
四种物质中属于化合物的是 (填图中字母)。
③ 若8gA参加反应,则生成C的质量为 g。
(3)海水晒盐能够得到粗盐和卤水。卤水中含有MgCl2、KCl和MgSO4等物质,右图是它们的溶解度曲线。t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是 。将t1℃的MgCl2、KCl和MgSO4三种物质的饱和溶液加热到t2℃以上时,可能会析出 晶体。
上海静安区高层住宅发生大火,元凶可能是所使用的一种易燃保温材料--聚氨酯泡沫塑料。据此回答下列问题:
(1)聚氨酯泡沫塑料属于(填"合成"或"金属")材料。根据这次大火灾,写出聚氨酯泡沫塑料的一点化学性质。
(2)聚氨酯泡沫塑料燃烧时产生的烟气中含有一种能与血液中血红蛋白结合的剧毒气体,该气体的化学式为。
下图形象地表示了在加热,催化剂的条件下,某化学反应前后反应物与生成物分子及其数目的变化。回答下列问题: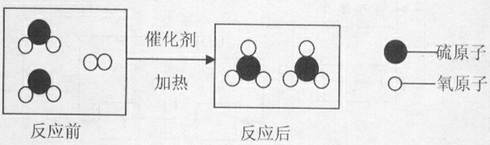
(1)上述过程中,共有种分子,属于单质的有种。
(2)写出该反应的化学方程式。
(3)你从上图获得的信息有。(写出一点即可)
今年上半年,湘潭地区降雨稀少,湘江水位下降,水质恶化。请你运用所学的知识解决下列问题。
(1)湘江水中含有许多杂质,可利用吸附、沉淀、过滤、蒸馏等方法净化,其中净化程度最高的是:。
(2)农村部分家庭引用的井水含大量可溶性钙镁化合物,给生活带来很多麻烦,生活中可用的方法来降低水的硬度。
化学就在我们身边,它能改善我们的生活。请从①氮气 ②纯碱 ③熟石灰中选出适当的物质并用其序号填空:
(1)侯氏制碱法中的碱是;
(2)可降低土壤酸性的是;
(3)充入灯泡能延长灯泡使用寿命的是。
用化学用语填空:
(1)2个硫原子;
(2)正二价的镁元素;
(3)四氧化三铁。