一些烷烃的燃烧热如下表:
| 化合物 |
燃烧热/kJ/mol |
化合物 |
燃烧热/kJ/mol |
| 甲烷 |
891.0 |
正丁烷 |
2 878.0 |
| 乙烷 |
1 560.8 |
异丁烷 |
2 869.6 |
| 丙烷 |
2 221.5 |
2甲基丁烷 |
3  531.3 531.3 |
下列表达正确的是
| A.正戊烷的燃烧热大约是3 540 kJ/mol |
| B.热稳定性:正丁烷>异丁烷 |
| C.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-1 560.8 kJ/mol |
| D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
石墨烯(Graphene)是目前已知的世界上最薄、最坚硬、导电性最好的纳米材料,几乎完全透明,具有极好的应用前景。英国曼彻斯特大学的Andre Geim教授和他的学生Konstantin Novoselov因发现石墨烯而获得2010年诺贝尔物理学奖。石墨烯可由石墨剥离而成,为单层片状结构,其结构如图所示。下列说法正确的是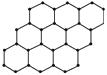
| A.石墨烯与石墨互为同位素 |
| B.石墨烯是一种能发生加成反应的有机化合物 |
| C.石墨烯中的碳原子均为sp2杂化 |
| D.12 g石墨烯中含有3 mol σ键 |
下列有关化学键与晶体结构的说法正确的是
| A.由两种元素组成的分子中一定只有极性键 |
| B.离子化合物的熔点一定比共价化合物的高 |
| C.由非金属元素组成的化合物一定是共价化合物 |
| D.含有阴离子的化合物一定有阳离子 |
下列各组分子或离子中,中心原子的杂化轨道类型相同的是
| A.CO2与NO2 | B.PCl3和BF3 | C.CO32-与SO32- | D.CH4和SO42- |
具有下列电子层结构的原子和离子,其对应元素一定属于同一周期的是
| A.两原子核外全部都是s电子 |
| B.最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子 |
| C.原子核外M层上的s、p能级都充满电子,而d能级上没有电子的两种原子 |
| D.两原子N层上都有1个s电子,一个原子有d电子,另一个原子无d电子 |
金属晶体、离子晶体、分子晶体和原子晶体的根本区别是
| A.基本构成微粒和微粒间的作用力不同 |
| B.外部形状不同 |
| C.金属晶体和原子晶体属于单质,分子晶体和离子晶体属于化合物 |
| D.基本构成微粒做周期性重复排列所遵循的规律不同 |