下列说法正确的是
A.原子最外层电子 数为2的元素一定处于周期表IIA族 数为2的元素一定处于周期表IIA族 |
B.主族元素X、Y能形成 型化合物,则X与Y 的原子序数之差可能为2或5 型化合物,则X与Y 的原子序数之差可能为2或5 |
| C.氯化氢的沸点比氟化氢的沸点高 |
| D.同主族元素形成的氧化物的晶体类型均相同 |
已知某溶液中存在 四种离子,其浓度大小有如下关系
四种离子,其浓度大小有如下关系
①
②
③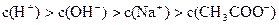
④
其中正确的是()
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
下列离子方程式书写正确的是()
A.用石墨为电极电解硫酸铜溶液:Cu  Cu+4H Cu+4H |
B.泡沫灭火器工作时化学反应: |
C.硫酸镁溶液与氢氧化钡溶液反应: |
| D.过量碳酸氢钠溶液与氢氧化钡溶液反应: |

为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性
②取少量溶液中入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体
③在上述溶液中再滴加Ba(NO3)3溶液,产生白色沉淀
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀
根据实验以下推测正确的是()
A.一定有 离子 离子 |
B.一定有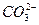 离子 离子 |
| C.Cl-离子一定存在 | D.不能确定HCO 离子是否存在 离子是否存在 |
25°C时,几种弱酸的电离常数如下
| 弱酸化学式 |
CH3COOH |
HCN |
H2S |
| 电离常数(25°C) |
1.8 |
 |
 |
25°时,下列说法正确的是()
A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.某浓度HCN的水溶液pH=d,则其中c(OH-)=10-dmol/L
D.NaHS和Na2S混合溶液中,一定存在c(Na+)+c(H+)===c(OH-)+c(HS-)+2c
(S2-)
对于平衡体系2SO2(g)+O2(g)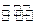 2SO3(g)△H<0。下列结论中正确的是()
2SO3(g)△H<0。下列结论中正确的是()
| A.若温度不变,将容器的体积增大一倍,此时的SO2浓度变为原来的0.5倍 |
| B.若平衡时SO2、O2的转化率相等,说明反应开始时,两者的物质的量这比为2:1 |
| C.若从平衡体系中分离出SO2,则有利于提高SO2的转化率和加快正反应速率 |
| D.平衡状态时SO2、O2、SO3的物质的量之比一定为2:1:2 |