下列有关实验原理或操作正确的是 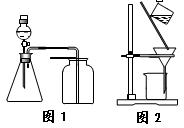
| A.选择合适的试剂,用图1所示装置可分别制取少量CO2、NO和O2 |
| B.制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸 |
| C.洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干 |
D.用广泛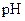 试纸测得0.10mol/LNH4Cl溶液的PH=5.2 试纸测得0.10mol/LNH4Cl溶液的PH=5.2 |
在溶液中能大量共存的一组离子或分子是
| A.K+ 、Al3+、SO42—、NH3·H2O | B.NH4+、H+、NO3—、HCO3— |
C.Na+ 、CH3COO—、CO32—、OH— |
D.Na+、K+、SO32—、Cl2 |
下列说法正确的是
| A.甲烷、汽油、生物柴油、酒精都是碳氢化合物,都可作燃料 |
| B.可食用植物油含有的高级脂肪酸甘油酯是人体的营养物质 |
| C.钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 |
| D.用CuSO4溶液使蛋清溶液发生盐析,进而提纯分离蛋白质 |
碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g) WI2(g)ΔH<0(温度T1<T2)。下列说法正确的是
WI2(g)ΔH<0(温度T1<T2)。下列说法正确的是
| A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W,W重新沉积到灯丝上 |
| B.灯丝附近温度越高,WI2(g)的转化率越低 |
C.该反应的平衡常数表达式是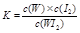 |
| D.利用该反应原理可以提纯钨 |
Cu2O 是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应为:2Cu+H2O Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是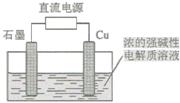
| A.石墨电极上产生氢气 |
| B.铜电极发生还原反应 |
| C.铜电极发生的电极反应为Cu—eˉ= Cu+ |
| D.当有0.2mol电子转移时,有0.1mol Cu2O生成 |
下图是部分短周期主族元素原子半径与原子序数的关系图,下列说法正确的是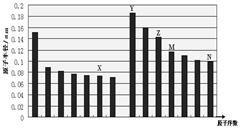
| A.最高价含氧酸的酸性:M>N |
| B.离子半径:X<Y |
| C.X和Y形成的化合物中一定含有含离子键 |
| D.化合物MX2能与碱反应,不能与任何酸反应 |