共价化合物含C、H、N三种元素。分子内有四个N原子,且排成四面体,每两个N原子之间都含有1个C原子。又知分子中无C一C键和C=C键,则该化合物的分子式
A.C3H8N4 B.C6H12N4 C.C6H10N4 D.C4H8N4
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常加入抗氧化物质,下列不属于抗氧化物质的是()
| A.维生素C | B.还原铁粉 | C.亚硫酸钠 | D.生石灰 |
某无色溶液既可能是强酸性又可能是强碱性,在该溶液中一定能大量共存的离子是()
A H+ Na+ NO3- SO42- B Na+ CO32- Cu2+Cl-
C K+ Na+ Cl-SO42- D K+ Cl-Ba2+ HCO3-
将下列各组物质按单质、氧化物、酸、碱、盐分类顺序排列,其中正确的是
| A.水银、干冰、硫酸、烧碱、食盐 | B.碘酒、冰、盐酸、烧碱、食盐 |
| C.氢气、二氧化硫、硝酸、纯碱、硫酸铜 | D.铜、氧化铜、醋酸、石灰石、氯化铜 |
有A、B、C、D 四种物质,它们是Fe、稀HCl、NaOH溶液、AgN03溶液四种物质中的一种,它们的反应关系及反应类型如下,则物质B为( )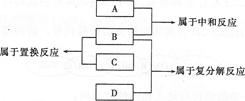
A.Fe B.HCl(稀) C.NaOH(溶液) D.AgNO3(溶液)
下列各项操作中不发生先沉淀后溶解现象的是( )
①向饱和碳酸钠溶液中通入过量的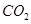 ②向
②向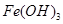 胶体中逐滴滴加入过量
胶体中逐滴滴加入过量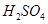
③向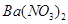 溶液中通入过量SO3④向石灰水中通入过量
溶液中通入过量SO3④向石灰水中通入过量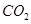
⑤向硅酸钠溶液中逐滴加入过量的盐酸
| A.①②③ | B.①②⑤ | C.①②③⑤ | D.①③⑤ |