在一定体积的密闭容器中放入3升气体R 和5升气体Q,在一定条件下发生反应:2R(气)+5Q(气)
和5升气体Q,在一定条件下发生反应:2R(气)+5Q(气) 4X(气)+nY(气)。反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是
4X(气)+nY(气)。反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是
A 2 B 3 C 4 D 5
食品香精菠萝酯的生产路线(反应条件略去)如下: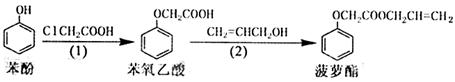
下列叙述错误的是
| A.步骤(1)和步骤(2)均发生的是取代反应 |
| B.生产路线中的五种有机物均可与NaOH溶液发生反应 |
| C.苯酚、苯氧乙酸和菠萝酯均可与溴在一定条件下发生取代反应 |
| D.苯氧乙酸的同分异构体中,苯环有两个侧链且属于有机羧酸酯类的同分异构体有15种 |
下列离子方程式或化学方程式书写正确的是
A.2AlCl3(熔融)  2Al + 3Cl2↑ 2Al + 3Cl2↑ |
B.电解CuCl2溶液:2Cu2+ + 2H2O 2Cu + 4H+ + O2↑ 2Cu + 4H+ + O2↑ |
C.硫酸氢铵溶液与足量烧碱稀溶液共热:NH4+ + H++ 2OH- 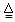 NH3↑+ 2H2O NH3↑+ 2H2O |
| D.氯化铁溶液中通入足量H2S气体:2Fe3+ + 3H2S = 2FeS↓ + S↓ + 6H+ |
下列叙述错误的是
| A.纤维素的水解实验操作为:把一小团棉花放入试管中,加入几滴90%的硫酸溶液,用玻璃棒把棉花捣成糊状,小火微热,至成亮棕色溶液 |
| B.向油脂发生皂化反应后所得的混合溶液中加入固体NaCl会出现分层现象,此过程发生的主要是物理变化 |
| C.当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| D.已知苯与苯酚的沸点差异较大,故可用蒸馏的方法分离苯与苯酚的混合液 |
设NA表示阿佛加德罗常数,下列说法正确的是
| A.标准状况下,22.4 L甲醛所含电子数约为16 NA |
| B.25℃时,pH=13的1 L Ca(OH)2溶液中含有OH-数目约为0.2 NA |
| C.0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA |
| D.常温常压下,4.6 g NO2气体含有0.1 NA个分子 |
某同学对某结构简式为 的有机物可能具有的化学性质进行如下预测:
的有机物可能具有的化学性质进行如下预测:
①可以使酸性高锰酸钾褪色。②可以和氢氧化钠溶液反应。③在一定条件下可以和乙酸发生反应。④在一定条件下能发生消去反应。⑤在一定条件下能与氢气发生反应。⑥遇到FeCl3溶液可以发生显色反应。其中错误的是()
| A.②④⑥ | B.①②④⑤ | C.②③⑥ |
D.④⑥ |