(6分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学 化学知识回答下列问题:
化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序___。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)____________________________________。
(3)浓度为0.1mol/L的(NH4)2Fe(SO4)2溶液与(1)相比c(NH4+) 中的大(填化学式)

已知,相关物质被氧化的难易次序是:RCHO最易,R—CH2OH次之, 最难。
最难。
请在下列空格中填写A、B、C、D的结构简式。
A.______________,B. ______________,C. ______________,D. ______________。

(1)各步所加的试剂为:A__________,B__________,C__________。
(2)_________(填“可以”或“不可以”)只加A溶液而不加B溶液,原因是_________
_______________________________________________________________________________。
(3)当析出2.16g单质沉淀时,淀粉的水解率为_________。
(4)上述实验中有一处明显的错误,应如何改正________________________________。
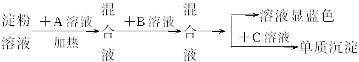
(1)各步所加的试剂为:A_____________,B_____________,C_____________。
(2)_____________(填“可以”或“不可以”)只加A溶液而不加B溶液,原因是____________________________________________________。
(3)当析出2.16 g单质沉淀时,淀粉的水解率为_____________。
用一氧化碳和氢气在443—473 K温度下,并用钴作催化剂时,可以反应生成
n=5—8的烷烃,这是人工合成汽油的方法之一。
(1)写出用CnH2n+2表示的人工合成汽油的配平的化学方程式_____________________。
(2)如果向密闭的合成塔里通入恰好能完全反应的CO和H2,当完全反应后,合成塔内温度不变,而塔内气体压强降低到原来的2/5。通过计算说明这时有无汽油生成。
(3)要达到上述合成汽油的要求,CO和H2的体积比的取值范围是多少?
某烃A分子式是C1 398H1 278,它由4种基团组成,这4种基团分别是 (3价)
(3价) (2价);
(2价); (2价);(CH3)3C—(1价)
(2价);(CH3)3C—(1价)
已知,该分子结构中没有苯环连接苯环、炔键连接炔键的情况,试求A分子中含有这4种基团各几个?