有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
| A.X、M两种元素只能形成X2M型化合物 |
| B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低 |
| C.元素Y、Z、W的单质晶体属于同种类型的晶体 |
| D.元素W和M的某些单质可作为水处理中的消毒剂 |
1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知每摩单质碳完全燃烧生成CO2放出热量为Y kJ,则1mol C与O2反应生成CO的反应热△H为()
| A.-Y kJ/mol | B.-(10X-Y) kJ/mol |
| C.-(5X-0.5Y) kJ/mol | D.+(10X-Y) kJ/mol |
锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,该电池的总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是()
| A.电解质溶液中混入水,对电池反应无影响 |
| B.上述过程中是电能转化成化学能 |
| C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3 |
| D.电池工作过程中,金属锂提供电子的物质的量与析出硫的物质的量之比为4 :1 |
当向蓝色的CuSO4 溶液中逐滴加入氨水时,观察到首先生
溶液中逐滴加入氨水时,观察到首先生 成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色溶
成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色溶 液中通入SO2气体,又生成了白色沉淀:将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下列描述正确的是()
液中通入SO2气体,又生成了白色沉淀:将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下列描述正确的是()
| A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子 |
| B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应 |
| C.白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下,Cu+只被氧化 |
| D.反应过程中消耗的SO2与生成的SO2的物质的量相等 |
在t℃下,某反应达到平衡,平衡常数K=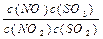 。恒容时,温度升高,NO浓度减小。下列说法正确的是()
。恒容时,温度升高,NO浓度减小。下列说法正确的是()
| A.该反应的焓变为正值 |
B.K表达式中 ,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度 ,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为:NO+SO3 NO2+SO2 NO2+SO2 |
下列离子方程式书写正确的是()
A.溴乙烷与6mol/L的氢氧化钠水溶液共热:C2H5Br+OH-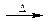 CH2=CH2↑+Br-+H2O CH2=CH2↑+Br-+H2O |
| B.等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液相混合: Ca2++2HCO3  -+2OH- -+2OH- CaCO3↓+CO32-+2H2O[ CaCO3↓+CO32-+2H2O[ |
| C.在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入1~2滴盐酸: 3Fe2++4H++NO3-  3Fe3++NO↑+2H2O 3Fe3++NO↑+2H2O |
D.在H2O2中加入酸性高锰酸钾溶液:2MnO4-+6H++5H2O2 2Mn2++5O2↑+8H2O 2Mn2++5O2↑+8H2O |