四氧化三铁纳米微粒可用于涂料、油墨、隐身材料、磁记录、电极材料、催化剂等多领域,实验室可用如下的方法来制备这种材料并进行检测。
Ⅰ.制备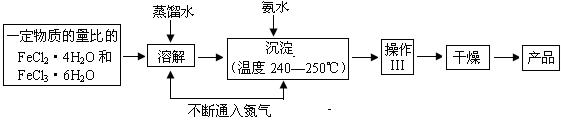
(1)溶解、沉淀操作中不断通入氮气有两个作用:①是通过在反应过程中通 入气体形成微型气泡,将刚生成的四氧化三铁微粒包围,来阻止微粒的长大或聚集成团;② ▲ 。
入气体形成微型气泡,将刚生成的四氧化三铁微粒包围,来阻止微粒的长大或聚集成团;② ▲ 。
(2)操作Ⅲ的名称是________▲___ 。
Ⅱ.产品检测
一、定性检测:产品中铁元素价态检测
试剂主要有:3mol/L硫酸、0.1mol/L氢氧化钠溶液、20%硫氰化钾溶液、0.01mol/L酸性高锰酸钾溶液、氯水(其它用品任选)
(3)请选用上述试剂完成下表
| 步骤 |
操作 |
现象、结论 |
| 1 |
▲ |
 |
| 2 |
取少量产品于试管中加适量步骤1处理好溶液溶解,配成溶液 |
固体溶解,溶液呈浅黄色 |
| 3 |
取少量步骤2配好溶液于试管中,滴加几滴20%硫氰化钾溶液,振荡 |
▲ ,产品含有Fe3+ |
| 4 |
▲ |
▲ ,产品含有Fe2+ |
二、定量测定:
称取23.2g样品于烧杯中,加入加热煮沸后的稀硫酸充分溶解,并不断加热、搅拌,待固体完全溶解后,向所得溶液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。取滤液体积的1/10用浓度为0.200 mol·L-1的酸性KMnO4 滴定,至终点时消耗KMnO4溶液体积29.80mL。
滴定,至终点时消耗KMnO4溶液体积29.80mL。
(4)产品中Fe3+和Fe2+的物质的量之比为 ▲ 。
III.结果讨论
(5)产品中Fe3+和Fe2+的物质的量之比略大于2:1的可能原因是 ▲ 。
用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:第一,有氧气生成;第二,____________。过氧化钠跟水反应的化学方程式是________________________,其中还原剂是________________________。
(2)某研究性学习小组拟用右图装置进行实验,以证明上述结论。
用以验证第一条结论的实验方法是:______________________________。
用以验证第二条结论的实验方法及现象是:_______________________________________。
(3)实验(2)中往试管内加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液变红;振荡后,红色褪去。为探究此现象,该小组同学查阅有关资料得知:Na2O2与H2O反应可生成H2O2,H2O2具有强氧化性和漂白性。请设计一个简单的实验,证明Na2O2和足量H2O充分反应后的溶液中有H2O2存在。现有Na2S溶液、KI溶液、红色布条等,请从中选择试剂,加以验证(只要求列出实验所用的试剂及观察到的现象)。
试剂:______________________________________________________________。
现象:______________________________________________________________。
科学家把药物连接在高分子载体上可制成缓释长效药剂阿斯匹林,它的结构为:
它可以接在一种高聚物载体上形成缓释长效药剂。其中的一种结构如下:
(1)写出载体的结构简式_____。
(2)服药后在人体可以缓缓地释放出阿斯匹林,写出此过程的化学方程式:____。
(3)这种高分子载体的单体的结构为_____。
 3H2O+N2,而氮化镁遇水即反应生成Mg(OH)2和NH3,下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框图(实验前系统内的空气已排除,图中箭头表示气体的流向)。
3H2O+N2,而氮化镁遇水即反应生成Mg(OH)2和NH3,下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框图(实验前系统内的空气已排除,图中箭头表示气体的流向)。
(1)甲、乙两生提出的实验方案是否能制得氮化镁?(填“能”或“不能”)甲______乙_____。
(2)具体说明不能制得氮化镁的原因(如果两个方案都能制得氮化镁,此小题不用回答)。
答:________________________________________。
四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃;金属锡的熔点为231℃,拟用以下仪器,设计组装一套实验装置,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)请回答下列各个问题。
| A.用玻璃管(未画出)连接上述装置,正确的顺序是(填各接口的代字母) ( )接( )、( )接( )、( )接( )、( )接( )、( )接( ); |
| B.装置Ⅵ作用是______;装置Ⅳ的作用是______; |
| C.冷凝管里冷水的流向是从______进入,从________流出; |
| D.实验时应先点燃_______处酒精灯,加热温度应大于______℃,待_______即可停止加热; |
E.已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,那么四氯化锡水解的化学方程式为_______。
F.如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是________。
G.为了防止污染空气,在装置的最后应_______。
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年的《化学教育》报道了如下实验研究:
一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请完成下列问题:
(1)反应后所得的溶液漂白性增强的原因是____________________________________。
(2)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有_________。
二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150 mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。
请完成下列问题:
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是____________________________________________________。
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少A g,总共收集到标准状况下的CO2气体B L,发现 明显小于
明显小于 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________________________________________。
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________________________________________。
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是____________________________________。