布洛芬、非诺洛芬、酮洛芬是一类芳基丙酸类非甾体抗炎药,具有抗炎作用强、毒副作用低的药效特点。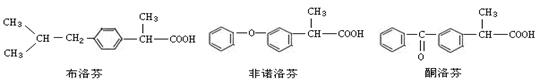
其中酮洛芬可由芳香族含氧衍生物A经以下路线合成得到: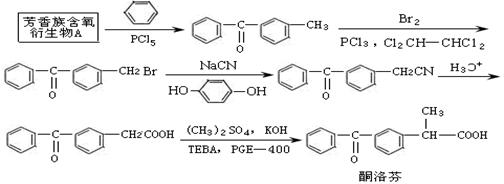
请根据合成酮洛芬的路线回答下列问题。
(1)已知有机物A可以与NaHCO3反应,则A的结构简式为 ▲ 。 (2)上述合成酮洛芬的路线中共有5步反应,其中属于取代反应的共有几步? ▲ 。其中有一步反应中用到有机物 ,请写出实验室保存该有机物方法: ▲ 。
(2)上述合成酮洛芬的路线中共有5步反应,其中属于取代反应的共有几步? ▲ 。其中有一步反应中用到有机物 ,请写出实验室保存该有机物方法: ▲ 。
(3 ) 布洛芬、非诺洛芬、酮洛芬都可视作2-苯基丙酸的衍生物,则芳香族含氧衍生物A与2-苯基丙酸的关系是 ▲ ;请写出满足下列条件的2-苯基丙酸的一种同分异构体的结构简式 ▲ 。
) 布洛芬、非诺洛芬、酮洛芬都可视作2-苯基丙酸的衍生物,则芳香族含氧衍生物A与2-苯基丙酸的关系是 ▲ ;请写出满足下列条件的2-苯基丙酸的一种同分异构体的结构简式 ▲ 。
①苯的衍生物,且苯环上的一硝基取代物只有两种;②能与银氨溶液反应产生光亮的银境;
③能与FeCl3溶液发生显色反应。
(4)参照上述合成路线中的有关信息,写出由对二甲苯为主要原料制备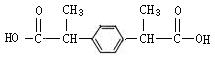 的合成流程图(无机试剂任选)。
的合成流程图(无机试剂任选)。
合成线路图示例如下:
(1)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为 ;
又知H2O(l)=H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ
(2)发射卫星时可用肼(N2H4)为燃料和NO2作氧化剂,这两者反应生成N2和水蒸气.又已知: ①N2(气)+2O2(气)=2NO2(气) △H=+67.7kJ/mol ②N2H4(气)+O2(气)=N2(气)+2H2O(气) △H=-534kJ/mol试写出肼与NO2反应的热化学方程式:
(3)甲烷燃料电池:碱性电解质(铂为两极、电解液KOH溶液)
正极:___________ _____
负极:__________
总反应方程式: CH4+ 2O2 + 2OH- = CO32- + 3H2O
电解原理在化学工业上有广泛应用。一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: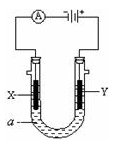
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液。
①电解池中X极上的电极反应式为_________________,在X极附近观察到的现象是_______________。
②Y电极上的电极反应式为________________,检验该电极反应产物的方法是_______________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液
①X电极的材料是_________________,电极反应式为_______________。
②Y电极的材料是 ________________,电极反应式为________________。
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
(1)该反应的化学方程式为:
(2)反应开始至2min,用X表示的平均反应速率为:
(3)下列叙述能说明上述反应达到化学平衡状态的是 (填字母)
A.混合气体的总物质的量不随时间的变化而变化
B.单位时间内每消耗3mol X,同时生成2mol Z
C.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入a mol H2(g)和bmol I2,发生反应H2 (g)+ I2 (g)=2HI(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)
① 降低温度: ②保持容器的体积不变,增加X(g)的物质的量:
③ 增大容器的体积: ④容器容积不变,通入氖气________________。
下列事实中是什么因素影响了化学反应速率?
①食品在夏天容易变质,冬天则不会出现该现象
②熔化的KClO3放出气泡很慢,撒入少量MnO2,会很快产生气体
③工业上常将固体燃料粉碎以提高燃烧效率
④同浓度等体积的硫酸与盐酸,和同样大小质量相等的锌粒反应,产生气体有快有慢
实验室用固体烧碱配制500ml 0.1mol/L的NaOH溶液。
(1)需称量 g的烧碱固体,固体应放在 中称量。
(2)配制过程中一定不需要使用的仪器是 (填写代号)
A、烧杯 B、玻璃棒
C、500ml容量瓶D、锥形瓶
E、胶头滴管 F、洗瓶
(3)由(2)中列出的仪器判断,完成实验还缺少的仪器是
(4)在容量瓶的使用中,下列操作不正确的是(填写代号)
A、使用容量瓶前检查是否漏水
B、容量瓶用蒸馏水洗净后,再用NaOH溶液洗涤
C、将烧碱固体在500ml烧杯中加约450ml水溶解,恢复至室温后转移至500ml容量瓶中,定容
D、盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动多次
(5)下列实验操作会使溶液的物质的量浓度偏大的是 (填写代号)
①容量瓶事先用蒸馏水洗涤,没有干燥就进行实验
②用玻璃棒搅拌溶解溶质时,用力过猛,一部分液体溅出烧杯
③转移完毕后,没有洗涤操作直接加水定容
④定容时俯视观察液面
⑤定容后对容量瓶内的溶液上下颠倒摇匀,发现凹液面低于刻度线,再加水至刻度线
⑥配制时,溶解后未经冷却将较浓的溶液转移入容量瓶
⑦定容时加水不小心超过刻度线,立即用胶头滴管将多余液体吸出