一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH=4K2CO3+10H2O,有关此电池的推断正确的是
| A.负极反应为14H2O+7O2+28e-=28OH— |
| B.放电一段时间后,负极周围的pH增强 |
| C.放电过程中KOH的物质的量浓度不变 |
| D.每消耗1molC2H6,则电路上转移的电子为14mol |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是高()
| A.反应达到平衡时,X的转化率为50% |
B.上述反应为X+3Y  2Z,其平衡常数为1600 2Z,其平衡常数为1600 |
| C.增大压强使平衡向生成Z的方向移动,平衡常数不变 |
| D.若改变温度反应的平衡常数变大,则一定为升高温度 |
X、Y、Z、M代表四种金属元素.金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子。则这四种金属的活动性由强到弱的顺序为()
| A.X>Y>Z>M | B.X>Z>Y>M | C.M>Z>X>Y | D.X>Z>M>Y |
25 ℃时,水的电离达到平衡:H2O  H+ + OH- ΔH > 0 ,下列叙述正确的是()
H+ + OH- ΔH > 0 ,下列叙述正确的是()
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,水的离子积常数不变 |
| C.向水中加人少量固体NaOH ,平衡正向移动,c(H+)降低 |
| D.将水加热,水的离子积常数增大,pH不变 |
下图表示2A(g)+B(g) 2C(g)(正反应放热)。这个可逆反应的正确图像为 ( )
2C(g)(正反应放热)。这个可逆反应的正确图像为 ( )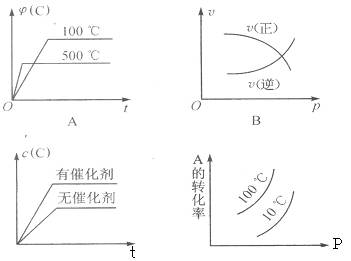
下列关于原电池的叙述中,正确的是()
| A.原电池中,正极就是阳极,负极就是阴极 |
| B.电子从负极经电解质溶液流向正极 |
| C.原电池工作时,溶液中的阳离子向负极移动 |
| D.形成原电池时,在负极上发生氧化反应 |