(15分)某强酸性溶液X可能含有Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO2-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下: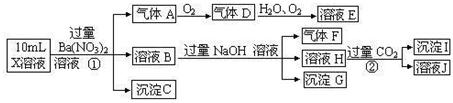
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是 ▲ ,不能确定是否含有的离子(M)是 ▲ ,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是 ▲ 。
▲ 。
(2)沉淀I的化学式为 ▲ ,气体F的电子式为 ▲ 。
(3)写出生成A的离子方程式: ▲ 。
(4)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4。请写出制备过程中的离子方程式 ▲ 。
(5)1.0mol/L的E溶液与2.0mol/LF溶液等体积混合完全反反应后,溶液中各离子的浓度大小关系为 ▲ 。
(6)假设测定A、F、I均为0.10mol,50mL X溶液中n(H+)=0.40mol,当沉淀C物质的量大于0.70mol时,溶液X中还一定含 ▲ 。
Fe2O3和Cu2O都是红色粉末,常用作颜料。某校研究性学习小组通过实验探究一包红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O溶于稀硫酸后生成Cu和CuSO4
提出假设:假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是。
(2)若滴加 KSCN 试剂后溶液无明显现象,则证明原固体粉末中一定不含Fe2O3。你认为这种说法合理吗?。(填“合理”或“不合理”)
(3)若固体粉末完全溶解即溶液中无固体存在, 滴加KSCN 试剂时溶液无明显现象, 则证明原固体粉末是,写出相关反应的离子方程式:
。
A-F六种元素中,除A外均为短周期元素,它们的原子结构或性质如表所示:
| 序号 |
元素 |
结构或性质 |
| ① |
A |
生活中常见的金属,它有两种氯化物,相对分子质量相差35.5 |
| ② |
B |
原子最外层电子数是内层电子数的1/5 |
| ③ |
C |
形成化合物种类最多的元素之一,其单质为固体 |
| ④ |
D |
地壳中含量最多的元素 |
| ⑤ |
E |
与D同主族 |
| ⑥ |
F |
与E同周期,且最外层电子数等于电子层数 |
(1)E元素在元素周期表中的位置为。
(2)B与D形成化合物的电子式是。
(3)CD2能与上述某些元素形成的物质发生置换反应,该反应化学方程式
是。
(4)A的一种氧化物与F的反应可用于焊接铁轨,写出相关反应的化学方程式:
。
(5)F元素的氧化物溶于浓NaOH溶液的离子方程式:
。
市面上消毒剂、漂白剂的种类繁多。
(1)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是。(填序号)
a.MnO2b.KMnO4溶液 c.稀盐酸 d.Na2SO3溶液
(2)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,会发生如下的分解,配平反应的离子方程式,并用单线桥标出电子转移的方向和数目:
HClO2 ——ClO2↑+H+ +Cl-+H2O
该反应中氧化剂与还原剂的质量之比为:。若有标准状况下11.2 L的ClO2生成,则转移的电子数是。
(3)氧化物X是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由NaClO3和Na2SO3按物质的量比2:1,并在H2SO4存在的条件下加热制得,则X为, 请写出相应的离子方程式。
右图为实验室某浓盐酸试剂瓶的标签上的有关
数据,试回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为mol/L。
若用KMnO4氧化上述 HCl。其反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl 2+5Cl 2↑+8H2O
(2)该反应中的氧化剂是、氧化产物
是。
(3)1mol KMnO4完全反应,被还原的HCl的物质的量为mol。
(4)8mol HCl完全反应,产生的Cl 2在标准状况下的体积为升。
实验室利用右图所示装置进行NaHCO3的受热分解实验。请回答: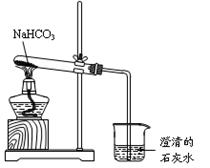
(1)加热一段时间后,烧杯中观察到的实验现象是 __。
(2)实验结束时的正确操作是(填序号)
① 先将导管从液体中移出,再熄灭酒精灯
② 先熄灭酒精灯,再将导管从液体中移出
(3)NaHCO3受热分解的化学方程式是___________
(4)若加热5.00 g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为_____________________克。