从下列事实所得出的结论或给出的解释正确的是
| |
实验事实 |
结论或解释 |
| ① |
将40 g NaOH溶于1 L蒸馏水中 |
该 溶液中溶质的质量分数为3.84%,其物质的量浓度为1mol﹒L-1 |
| ② |
在溶液的稀释过程中 |
离子浓度有的可能增大,有的可能减小,有的可能不变 |
| ⑶ |
某盐NaX溶液pH > 7 |
酸HX为弱酸 |
| ④ |
0.1 mol/L CH3COOH溶液在稀释过程中 |
 将变小 将变小 |
| ⑤ |
向盛有浓硝酸的试管中分别加入Al片和 Cu片,前者没有明显现象,后者反应剧烈,产生大量红棕色气体 |
还原性Al < Cu[ |
| ⑥ |
BaSO4的水溶液导电性很差 |
BaSO4是弱电解质 |
| A.①④⑤ | B.③④⑥ | C.②③ | D.②④⑥ |
对下列物质:①H2SO4、②CO2、 ③NaOH、④BaSO4、 ⑤NH3、⑥SO2、 ⑦NH3·H2O 、⑧C2H5OH、⑨Cu、⑩氯化钠溶液按要求分类不正确的是
| A.弱电解质:④、⑦ | B.电解质:①、③、④、⑦ |
| C.非电解质:②、⑤、⑥、⑧ | D.强电解质:①、③、④ |
标准状况下V L氨气溶解在1 L水中(水的密度为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是
| A.ρ=(17V+22 400)/(22.4+22.4V) | B.w=17c/(1 000ρ) |
| C.w=17V/(17V+22 400) | D.c=1 000Vρ/(17V+22 400) |
若20g密度为ρg·cm-3的硝酸钙溶液里含1g Ca2+,则NO 的物质的量浓度是
的物质的量浓度是
A. mol·L-1 mol·L-1 |
B.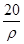 mol·L-1 mol·L-1 |
| C.2.5ρmol·L-1 | D.1.25ρmol·L-1 |
为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( )
| 序号 |
物质 |
杂质 |
除杂质应选用的试剂或操作方法 |
| ① |
KNO3溶液 |
KOH |
滴入稀HNO3同时用pH计测定至溶液呈中性 |
| ② |
FeSO4溶液 |
CuSO4 |
加入过量铁粉并过滤 |
| ③ |
H2 |
CO2 |
依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| ④ |
NaNO3 |
CaCO3 |
加稀盐酸溶解、过滤、蒸发、结晶 |
A.①②③ B.②③④ C.①③④ D.①②③④
下列溶液中的Cl-浓度与50mL 1mol·L-1MgCl2溶液中的Cl-浓度相等的是()
| A.150mL 1mol·L-1 NaCl溶液 | B.75mL 2mol·L-1 CaCl2溶液 |
| C.150mL 2mol·L-1KCl溶液 | D.75mL 1mol·L-1 AlCl3溶液 |