.I下表是部分短周期元素的原子半径及主要化合价:
| 元素代号[ |
W |
R |
X |
Y |
Z |
Q |
M |
| 原子半径/nm |
0.037 |
0.186 |
0.074 |
0.075 |
0.077 |
0.150 |
0.160 |
| 主要化合价 |
+1 |
+1 |
-2 |
-3、+5 |
+2、+4 |
+3 |
+2 |
试用元素符号 、化学式回答下列问题:
、化学式回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是 。
M在Z的最高价氧化物中燃烧的化学方程式 。
(2)X可与R按1︰1的原子个数比形成化合物甲,甲中存在的化学键有 ;
X可与W组成含18电子的化合物乙,则乙的电子式为 。
(3)上述元素组成的物质D、E在体积不变的密闭容器中发生可逆反应:2E(g)+D(g) 2G(g)根据下表中的数据判断下列图像错误的是 。
2G(g)根据下表中的数据判断下列图像错误的是 。
 |
p1(MPa) |
P2(MPa) |
| 200 |
78.4 |
90.6 |
| 600 |
72.3 |
88.6 |
|


按顺序写出实现下列转化的化学方程式
CH3CH2Br → CH3CH2OH→CH2==CH2 →CH2BrCH2Br
(1)
(2)
(3)
给下列有机物命名
A.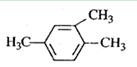 |
B.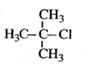 |
C.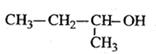 |
D.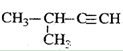 |
配平并完成下面离子方程式:
HCl + KClO3=Cl2 + KCl+ [ ]
(1)写出离子方程式:
硫酸钠溶液与氯化钡溶液
铝片与硝酸汞溶液。
(2)写出与下列离子方程式相对应的化学方程式:
H+ + OH-= H2O
Cu2+ + Fe=" Cu" + Fe2+。
(6分)今有10种物质:①石墨、②硫酸钡、③盐酸、④氨气、⑤石灰水、⑥氢氧化镁、⑦熔融NaCl、⑧蒸馏水、⑨二氧化硫、⑩固体氧化钠。其中:(填序号)
(1)属于电解质的是。
(2)属于非电解质的是。
(3)能导电的是。