下列关于化学反应叙述中,正确的是
| A.当1 mol Na2O2与足量SO2反应,转移电子1 mol |
| B.用食醋溶解水垢中的碳酸钙,可用离子反应式表示为: 2CH3COOH+CaCO3==Ca2++2CH3COO-+H2O+CO2↑ |
| C.实验室制SO2气体,可用Na2SO3溶液与稀H2SO4反应 |
D.Cu和浓HNO3反应可写成:Cu+4HNO3(浓)=Cu2++2NO +2NO↑+2H2O +2NO↑+2H2O |
T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是()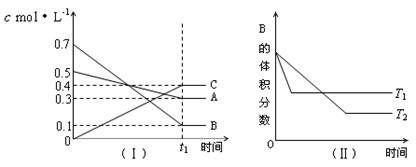
A.在(t1+10)min时,其他条件不变,增大压强,平衡向逆反应方向移动
B.(t1+10)min时,保持容器总压强 不变,通入稀有气体,平衡向右方向移动
不变,通入稀有气体,平衡向右方向移动
C.T℃时,在相同容器中,若由0.3mol·L-1 A、0.1 mol·L-1 B和0.4 mol·L-1 C反应,达到平衡后,C的浓度仍为0.4 mol·L-1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
在一定条件下,在固定容积的密闭容器中,能表示反应X(气)+2Y(气)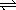 2Z(气)一定达到化学平衡状态的是()
2Z(气)一定达到化学平衡状态的是()
| A.容器内压强不随时间改变 |
| B.c(X).c(Y)2=c(Z)2 |
| C.正反应生成Z的速率与逆反应生成X的速率相等 |
| D.容器内混合气体的密度不随时间改变 |
碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)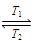 WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是( )
WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是( )
A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W然后W重 新沉积到灯丝 新沉积到灯丝 上 上 |
| B.灯丝附近温度越高,WI2(g)的转化率越低 |
C.该反应的平衡常数表达式是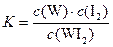 |
| D.利用该反应原理不可以提纯钨 |
靠一组镍氢电池驱动,一台试运行的混合动力公交车两年内跑了10万公里。大功率镍氢动力电池及其管理模块,是国家“十五”863计划电动汽车重大专项中一项重要课题。我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金LaNi5H6 (LaNi5H6中各元素化合价均为零),电池反应通常表示为( )
LaNi5H6 + 6NiO(OH) LaNi5 + 6Ni(OH)2
LaNi5 + 6Ni(OH)2
下列说法正确的是
| A.放电时储氢合金作正极 | B.充电时储氢合金作阳极 |
| C.充电时阳极周围c(OH-)增大 | |
| D.放电时负极反应:LaNi5H6 + 6OH- - 6e- = LaNi5 + 6H2O |
下图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为:2K2S2+KI3 K2S4+3KI。装置(Ⅱ)为电解池的示意图。当闭合开关K时,X附近溶液先变红。则下列说法正确的是( )
K2S4+3KI。装置(Ⅱ)为电解池的示意图。当闭合开关K时,X附近溶液先变红。则下列说法正确的是( )
| A.闭合K时,K+从右到左通过离子交换膜 |
| B.闭合K时,A的电极反应式为:3I--2e-===I |
| C.闭合K时,X的电极反应式为:2Cl--2e-===Cl2↑ |
| D.闭合K时,当有0.1 mol K+通过离子交换膜,X电极上产生标准状况下气体1.12 L |