将铝制品与铁棒作电极,以NaHCO3溶液作电解液进行电解,通电后在铝制品与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电解液从小孔通过并产生热量,使氢氧化铝分解,从而在铝制品表面形成一层较厚的氧化膜.对于这一电解过程中叙述不正确的是
| A.铝是阳极,铁是阴极 |
| B.使用NaHCO3溶液作为电解液,能减缓阴极区的pH增大 |
| C.电解液必须保持pH的相当稳定 |
| D.该电解过程中阳极反应式是:Al-3e-=Al3+ |
下列说法正确的是()
| A.电池放电时,电能转变为化学能 |
| B.直接燃烧煤比将煤进行处理转化为气体或液体燃料再燃烧效果好 |
| C.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关 |
| D.所有燃烧反应都是放热反应,所以不需任何条件就可以进行 |
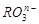 共有
共有 个核外电子,R的质量数为A,R的中子数是
个核外电子,R的质量数为A,R的中子数是
A. |
B. |
C. |
D.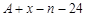 |
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期, Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
| A.X的氢化物溶于水显酸性 |
| B.Y的氧化物是离子化合物 |
| C.Z的氢化物的水溶液在空气中存放不易变质 |
| D.X和Z的最高价氧化物对应的水化物都是弱酸 |
下列各组物质中属于同分异构体的是
| A.H2O和D2O |
| B.乙醇(CH3CH2OH)和二甲醚(CH3 CH2-O-CH2CH3 ) |
C. |
D. |
下列说法正确的是
| A.任何单质分子都有化学键 |
| B.元素原子的价电子数一定是最外层电子 |
| C.分子式为CnH2n+2 ,n不同的化合物一定为同系物 |
| D.分子式为CnH2n,n不同的化合物一定为同系物 |