某温度下,容积一定的密闭容器中进行如下可逆反应:
X(g) + Y(g)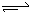 2Z(g) + W(s) △H>0,下列叙述正确的是
2Z(g) + W(s) △H>0,下列叙述正确的是
| A.加入少量W,逆反应速率增大 | B.当容器中气体压强不变时,反应达到平衡 |
| C.使用高效催化剂,X的转化率增大 | D.升高温度,平衡正向移动 |
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是
| A.Mg2+、Al3+、Fe2+ | B.H+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ | D.只有Mg2+、Al3+ |
今有三个氧化还原反应:①2FeCl3+2KI="2" FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3③2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和Cl-。可加入的试剂是
| A.Cl2 | B.KMnO4 | C.FeCl3 | D.HCl |
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为()
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为()
| A.5∶4 | B.5∶3 | C.1∶1 | D.3∶5 |
向某晶体的水溶液中加入Fe2+的溶液后,无明显变化,当滴加几滴氯水后,混合液出现红色。那么,由此得出下列的结论错误的是
| A.该晶体中一定含有SCN- | B.Fe3+的氧化性比Cl2的氧化性强 |
| C.Fe2+被Cl2氧化为Fe3+ | D.Fe2+与SCN-不能形成红色的化合物 |
在下列反应过程中,有3mol电子转移的是()
| A.lmol钠与水反应 | B.27g铝与足量盐酸反应 |
| C.22.4L氧气(标准状况)与足量镁反应 | D.1.5mol Na2O2与足量水反应 |