用碱性氢氧燃料电池为电源进行电解的实验装置示 意图如下所示。下列说法中正确的是
意图如下所示。下列说法中正确的是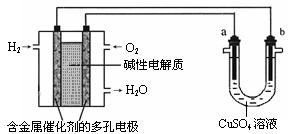
| A.燃料电池工作时,负极反应为:H2 – 2e-= 2H+ |
| B.若要实现铁上镀铜,则a极是铁,b极是铜 |
| C.若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
| D.a、b两极均是石墨时,在相同条件下当电池中消耗H222.4L(标准状况)时,a极析出铜64g |
某校学生用化学知识解决生活中的问题,下列家庭小实验不合理的是()
| A.在火炉上放一壶水防止煤气中毒 |
| B.用灼烧并闻气味的方法区别纯棉织物和纯毛织物 |
| C.用食醋除去暖水瓶中的薄层水垢 |
| D.用食用碱(Na2CO3)溶液洗涤餐具上的油污 |
小红在纸叠的小船中加入适量的水,用酒精灯直接加热,纸船安然无恙。纸船没有燃烧的主要原因是()
| A.纸不是可燃物 | B.没有与氧气接触 | C.水能灭火 | D.没有达到着火点 |
“关爱生命,拥抱健康”。人们在日常生活中的下列行为会损害人体健康的是()
| A.用碳酸氢钠焙制糕点 | B.在易碎的食品包装袋中充入氮气 |
| C.炖排骨时滴加一定量的食醋 | D.用霉变花生(含黄曲霉素)压榨花生油 |
保护环境,提高环保意识是每个公民的义务和责任。为了改善我们的生存环境,下列几项措施你认为切实可行的是()
①推广使用标有CNG(压缩天然气)的公交客车 ②将废旧电池深埋地下 ③控制烟花爆竹的燃放 ④垃圾分类回收 ⑤控制生活污水和工业废水的任意排放
| A.只有①②④ | B.只有①③④⑤ | C.只有①③⑤ | D.只有②③④⑤ |
铜和镁的合金2.14 g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO2、NO、N2O三种气体而且在标准状况下它们的体积均为0.224 L。在反应后的溶液中,加入足量的氢氧化钠溶液,生成的沉淀经过滤、洗涤、干燥后称量,质量为()
| A.4.18g | B.3.12g | C.4.68g | D.5.08 |