下列反应或过程属于吸热的是
| A.盐酸与NaOH溶液的反应 | B.H + H= H2 |
| C.Al和Fe2O3的铝热反应 | D.Ba(OH)2.8H2O与NH4Cl反应 |
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g)ΔH 1=+489.0 kJ·mol-1,
C(s) +CO2(g)=2CO(g)ΔH 2 =+172.5 kJ·mol-1;则CO还原Fe2O3(s)的热化学方程式为
| A.Fe2O3+ 3CO=2Fe+ 3CO2 △H=-28.5 kJ·mol-1 |
| B.Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H=-28.5 kJ |
| C.Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H= + 28.5 kJ·mol-1 |
| D.Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H=-28.5 kJ·mol-1 |
下列反应的离子方程式正确的是
A.HCO3-的水解方程式为:HCO3-+H2O H2CO3+OH— H2CO3+OH— |
| B.氢氧燃料电池的负极反应式:O2 + 2H2O+ 4e-=4OH- |
C.用铜做电极电解NaCl溶液:2Cl-+2H2O Cl2↑+H2↑+2OH— Cl2↑+H2↑+2OH— |
D.用惰性电极电解CuCl2溶液:2Cu2++2H2O 4H++O2↑+2Cu 4H++O2↑+2Cu |
下列说法正确的是
| A.铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
| D.纯碱溶于热水中去污效果增强,说明纯碱的水解是放热反应 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.1 L 0.1mol·L-1的氨水含有0.1NA个OH- |
| B.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA |
| C.在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数为NA |
| D.25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0 .1 NA |
常温下,下列溶液中各组离子一定能大量共存的是
| A.使甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、CO32- |
| B.由水电离产生的c(H+)=10-12mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
| C.c(H+)/c(OH-)= 1×1014的溶液: Ca2+、Na+、ClO-、NO3- |
D.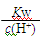 =0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3- =0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3- |