H+浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是
①反应所需要的时间B>A,②开始反应时的速率A>B,③参加反应的锌的物质的量A=B,④反应过程的平均速率 B>A ⑤盐酸里有锌剩余 ⑥醋酸里有锌剩余
| A.③④⑥ | B.②③⑥ | C.③④⑤ | D.①②⑤ |
下列各组离子在指定的溶液中能大量共存的是
①无色溶液中:K+、Cu2+、Na+、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+
④在由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl-、S2-、ClO-
⑥强酸性溶液中:Fe2+、Al3+、NO3-、Cl-
| A.①②⑤ | B.②④⑥ | C.②④ | D.③⑤⑥ |
向100mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是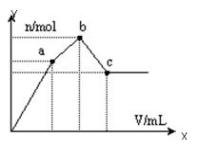
| A.c点溶液呈碱性 |
| B.b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH— = Al(OH)3↓+2BaSO4↓ |
| C.c点加入Ba(OH)2溶液的体积为200 mL |
| D.a点的溶液呈中性 |
用CH4催化还原NOx可以消除氮氧化合物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
下列说法中错误的是
| A.等物质的量的CH4在反应①、②中转移电子数相同 |
| B.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l);△H>-574kJ/mol |
| C.4NO2(g)+2N2(g)=8NO(g);△H=+586kJ/mol |
| D.若用标准状况下4.48L CH4把NO2还原为N2,整个过程中转移的电子总数为1.6NA |
下列叙述中,正确的是
| A.石油、煤、天然气、氢气都属于化石燃料 |
| B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH<0 |
| C.人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,某物质的热值越高则其标准燃烧热越大 |
D.两个体积相同的容器中充入等量的NO2发生反应:2NO2(g) N2O4(g) ΔH<0,绝热容器中气体的颜色比恒温容器中颜色深 N2O4(g) ΔH<0,绝热容器中气体的颜色比恒温容器中颜色深 |
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
| 序号 |
甲 |
乙 |
丙 |
| ① |
CO2 |
SO2 |
石灰水 |
| ② |
HCl |
CO2 |
石灰水 |
| ③ |
CO2 |
SO2 |
Ba(NO3)2 |
| ④ |
NO2 |
SO2 |
BaCl2 |
| ⑤ |
CO2 |
NH3 |
CaCl2 |
A.②③④B.②③④⑤C.①③④D.①②③④