I2在KI溶液中存在下列平衡:I2(aq)+I—(aq) I—3(aq)。I2、KI混合溶液中,I—3的物质的量浓度c(I—3)与温度T的关系如图所示(曲线上任何一点都表示平衡
I—3(aq)。I2、KI混合溶液中,I—3的物质的量浓度c(I—3)与温度T的关系如图所示(曲线上任何一点都表示平衡 状态)。下到说法正确的组合是:
状态)。下到说法正确的组合是: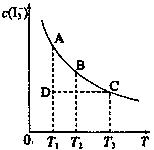
①反应I2(aq)+I—(aq) I—3(aq)的△H>0
I—3(aq)的△H>0
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
③若反应进行到状态D时,一定有v正>v逆
④状态A与状态B相比,状态A的c(I2)大
⑤保持温度不变,在该混合液中加水,c(I—3)/c(I2)将变大
| A.②③ | B.①③⑤ | C.③④⑤ | D.①④⑤ |
常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是 ( )
| A.ROH是一种强碱,MOH是一种弱碱 |
| B.在x点,c(M+)=c(R+) |
| C.稀释前,c(ROH)<10c(MOH) |
| D.稀释前,c(ROH)=10c(MOH) |
在一定条件下,Na2CO3溶液中存在水解平衡:CO32﹣+H2O HCO3﹣+OH﹣。下列说法不正确的是()
HCO3﹣+OH﹣。下列说法不正确的是()
| A.通入CO2,溶液pH减小 |
| B.加入少量NH4Cl固体,平衡向正反应方向移动 |
| C.慢慢升高温度,c(HCO3-)/ c(CO32-)逐渐增大 |
| D.加入NaOH 固体,溶液的KW=c(OH﹣)·c(H+)增大 |
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是()
| A.c(OH﹣)>c(H ClO)>c(H2CO3)>c(H+) |
| B.c(OH﹣)>c(HCO3﹣)>c(ClO﹣)>c(H+) |
| C.c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3) |
| D.c(Na+)+c(H+)=c(HCO3﹣)+c(ClO﹣)+c(OH﹣) |
下列说法正确的是()
| A.常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| C.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| D.物质的溶解度随温度的升高而增加,物质的溶解都是吸热的 |
25℃时,Kw=1.0×10﹣14;100℃时,Kw=5.5×10﹣13.下列说法正确的是( )
| A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7 |
| B.25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7 |
| C.25℃时,0.2 mol/L NaOH溶液与0.2 mol/L CH3COOH恰好中和,所得溶液的pH=7 |
| D.25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7 |