上海世博会英国馆——种子圣殿,由六万多根透明的亚克力[其分子式是(C5H8O2)n]杆构建而成。某同学从提供的原料库中选择一种原料X,设计合成高分子亚克为的路线如图所示: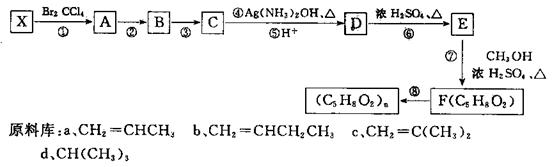
请回答:
(1)原料X是____(选填序号字母),其核磁共振氢谱有____个峰,峰面积之比为 。
(2)反应②的条件是____;反应⑧的反应类型是____;
(3)C有多种同分异构体,其中分子中含有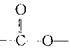 结构的同分异构体有 种,请写出其中任意两种的结构简式____、____。D中官能团的名称 。
结构的同分异构体有 种,请写出其中任意两种的结构简式____、____。D中官能团的名称 。
(4)写出⑦的化学方程式 。
(1)石灰水因在空气中久置出现了较多白色浑浊,某学生欲分离得到澄清石灰水,他应该选取的分离方法是___________;分离过程中除使用铁架台(带铁圈)、烧杯、滤纸外,必须使用的仪器还有(填写仪器名称)___________________。
(2)下列都是实验室常用的化学仪器,其中有“0”刻度线的是_______________(填入仪器序号,下同)。可以在酒精灯火焰上直接加热的有___________。
A.容量瓶 B.滴定管 C.试管 D.温度计
E.烧瓶 F.量筒G.烧杯 H.坩埚
(3)实验室可以用下图所示装置,以MnO2粉末和H2O2为试剂制取氧气。下列几种也是中 学化学实验中需要制取的气体,这些气体中也能用右图所示装置制取的有(填写气体化学式前的序号)________________。
A.Cl2 B.H2C.CH2=CH2 D.NO2 E.CH≡CH F.CO2
A、B、C、D是四种可溶的化合物,分别由阳离子K+、Ba2+、Al3+、Fe3+和阴离子OH―、CO32―、NO3―、SO42―两两组合而成,它们的溶液发生如下反应:
A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。C与D反应生成有色沉淀,B与C反应生成白色沉淀。写出它们的化学式:
A:_____________;B:_____________;C:_____________;D:_____________。
有X、Y、Z三种单质和甲、乙、丙三种常见的化合物,它们有如下图及叙述所示的关系,据此回答下列问题: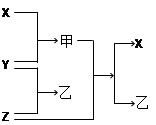

(1)X、Y、Z都是短周期元素的单质,X元素原子的最外层电子数是其次外层电子数的2倍;Y元素有两种常见单质,二者质量相等时其物质的量之比为3 :2;Z元素原子的次外层电子数是其最外层电子数的4倍。则:
①写出化合物甲的电子式__________;②写出Z与甲反应的化学方程式_____________。
(2)X、Y、Z都是非金属单质,X是原子晶体,Y、Z都是分子晶体,X、Y都能与强碱溶液反应;乙的水溶液是工业三酸之一,也是实验室常用试剂。则:
①写出X与NaOH溶液反应的离子方程式__________________________________;
②Z与甲的反应的一种重要工业用途是_____________________________________;
③在①所得溶液中加入乙的溶液,观察到的现象______________________________。
(3)X、Z是常见金属,Z与甲的反应只有在高温下才能进行,甲是一种具有磁性的化合物,乙在工业上常用于制取Z单质。则:
①写出乙与NaOH溶液反应的化学方程式__________________________;
②将①所得溶液与小苏打溶液的混合观察到的现象___________________________;
③将等物质的量的X和Z分别与足量的稀硫酸反应,当两种金属完全溶解后,得到气体的质量之比是____________________________。
化学式为C8H1018O的化合物A具有如下性质:
①A+Na→产生气泡 ②A+RCOOH→有果香味的产物
③A能使KMnO4酸性溶液褪色(被氧化为苯甲酸)
④A的催化氧化产物不能发生银镜反应
⑤A脱水反应的产物经聚合可制成一种塑料制品
(1)A中含氧官能团的名称是,性质⑤中脱水反应的反应类型是。
(2)A的结构简式是,写出三种A的同分异构体的结构简式,它们均能与NaOH反应且苯环上的一溴代物均只有两种。
(3)A与甲酸反应的方程式(必须注明18O的位置)。
(4)A脱水后的产物发生聚合反应的产物的结构简式。
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下: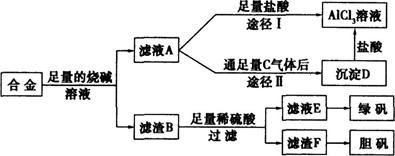
试回答下列问题:
(1)过滤用的器材已有:滤纸、铁架台、铁圈、烧杯和玻璃棒,还要补充的玻璃仪器是 。
(2)如何用实验证明沉淀D已洗涤干净 。
(3)由滤液A制得AlCl3溶液有途径I和Ⅱ两条,你认为合理的是途径 (填写“I”或“Ⅱ”),理由是;请写出途径Ⅱ得到沉淀D的离子方程式 。
(4)从滤液E中得到绿矾晶体的实验操作是蒸发浓缩、 、过滤。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,但前者的方案更合理,理由是 。
| A.后者消耗的酸和碱更多 | B.后者难以实现物质分离 |
| C.前者制得的产物更纯净 | D.前者操作步骤更少,方案简单 |