某校兴趣小组对氢氧化钠溶液和稀盐酸混合后的有关问题,进行了如下探究:
Ⅰ.(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发 生反应,设计并完成了如图所示
生反应,设计并完成了如图所示
实验。
X溶液是 ,滴入的量一般为 。
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有氢氧化钠溶液的 试管中,用胶头滴管慢慢滴入稀盐酸,不断振荡溶液,同时测定溶液的pH,直至盐酸过量。
试管中,用胶头滴管慢慢滴入稀盐酸,不断振荡溶液,同时测定溶液的pH,直至盐酸过量。
①写出测定溶液pH的方法: 。
②上图中哪个图像符合该同学的记录 (填序号)。
(3)你认为甲、乙两位同学的实验中, (填“甲同学”、“乙同学”或“甲、乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由: 。
Ⅱ.丙同学测出10mL 10%的NaOH溶液和不同体积的10%的盐酸溶液混合过程中,溶液的温度变化见下表(假设两溶液密度相同)。
| 加入盐酸的 体积( 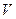 )/mL )/mL |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
| 溶液温度上升 |
5.2 |
9.6 |
12.0 |
16.0 |
18.2 |
16.7 |
15.7 |
14.7 |
13.7 |
就此实验回答:
(4)盐酸和氢氧化钠的反应是 (填“吸热”或“放热”)反应。
(5)请在图中绘制出溶液的温 度上升与加入盐酸体积之间的变化关系图,并在曲线上画出能表示两者之间恰好完全反应的点,并用字母P表示。
度上升与加入盐酸体积之间的变化关系图,并在曲线上画出能表示两者之间恰好完全反应的点,并用字母P表示。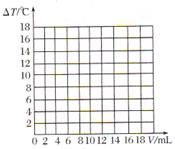
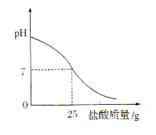
Ⅲ.丁同学为测定标示质量分数为32%的盐酸的实际质量分数,用pH测定仪组成实验装置。实验时先在烧杯中加入20g 40%的氢氧化钠溶液,再逐滴加入该盐酸,pH测定仪打印出加入盐酸的质量与烧杯中溶液的pH关系如图所示。
(6)请以此次测定的结果为依据计算该盐酸的实际质量分数为 。
(7)请分析你的计算结果与标签标示的质量分数不一致的可能原因(若一致,此空可不填): 。
300℃时,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g)△H,2min末达到平衡,生成0.8mol D。
2C(g)+2D(g)△H,2min末达到平衡,生成0.8mol D。
(1)在2min末时,A的平衡浓度为_____________,B的转化率___________,0-2min内D的平均反应速率为_____________。
(2)该反应的平衡常数表达式为:K=_____________。该温度下的化学平衡常数数值为 =____________。
=____________。
已知350℃时 =l,则△H________0(填“>”或“<”)。
=l,则△H________0(填“>”或“<”)。
(3)在300℃时,将该反应容器压缩体积为lL。则A的转化率___________(填“增大”、“减小”或“不变”),原因是__________________。该条件下的平衡常数为 。 则K3________
。 则K3________ ,(填“<”或“>”或“=”)。原因是_______________________。
,(填“<”或“>”或“=”)。原因是_______________________。
(4)能判断该反应是否达到化学平衡状态的依据是__________________(多选扣分)。
A.容器中压强不变 B.混合气体中c(A)不变
C. (A)=
(A)= (C) D.混合气体密度不变
(C) D.混合气体密度不变
在某密闭容器内有正反应为放热的可逆反应,其中A、B为气体,C为固体,若反应开始经 s后达平衡。如图:
s后达平衡。如图:
(1)该反应的化学方程式为_________________________
(2)反应物的转化率______________________
(3)要使反应物的转化率增加可能的原因是____________
A.增大了B或C的浓度 B.使用了催化剂
C.缩小体积,使体系压强增大 D.升高了反应温度
(4)该反应达到平衡后,向该容器中再充入0.5mol的He。若恒温恒压,,这时反应速率 _________(填“加快”、“减慢”或“不变”),平衡_____________ (填“向正方向移动”、“向逆方向移动”、“不移动”);若恒温恒容时,这时反应速率_______(填“加快”、“减慢”或“不变”),反应物的转化率___________(填“加快”、“减慢”或“不变”)。
(1)CH4(g )+2O2(g )=CO2(g )+2H2O(g ) ΔH=-802.3kJ/mol
该热化学反应方程式的意义是_____________________________________。
(2)已知2g乙醇完全燃烧生成液态水放出Q kJ的热量,写出表示乙醇燃烧热的热化学方
程式:____________________________________________________________.
(3)已知拆开1mol H-H键,1mol N-H键,1mol  键分别需要的能量是436kJ、391KJ、946kJ,则N2与H2反应生成1mol NH3(g)的热化学方程式是___________________.
键分别需要的能量是436kJ、391KJ、946kJ,则N2与H2反应生成1mol NH3(g)的热化学方程式是___________________.
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(石墨,s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol①
2H2(g)+O2(g)=2H2O(l)ΔH=-571.6kJ/mol②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH=-2599kJ/mol③
根据盖斯定律,计算298K时由C(石墨,s)和H2(g)生成1mol C2H2(g)反应的焓变:
____________________________.
一定温度下的密闭容器中存在如下反应:
CO(g)+H2O(g) CO2(g)+ H2(g),已知CO(g)和H2O(g)的起始浓度均为2 mol·L-1,经测定该反应在该温度下的平衡常数K =1,试判断:
CO2(g)+ H2(g),已知CO(g)和H2O(g)的起始浓度均为2 mol·L-1,经测定该反应在该温度下的平衡常数K =1,试判断:
(1)当CO转化率为25%时,该反应是否达到平衡_______,若未达到平衡,向哪个方向进行______。
(2)达到平衡时,CO的转化率____________________。
(3)当CO的起始浓度仍为2 mol·L-1,H2O(g)的起始浓度为6 mol·L-1,求平衡时CO的转化率_______。
在一定条件下,可逆反应A2(g)+B2(g) 2C(g)在一个密闭容器中达到平衡时,测得c(A2)=0.5mol·L-1,c(B2)=0.1mol·L-1,c(C)=1.6mol·L-1。若
2C(g)在一个密闭容器中达到平衡时,测得c(A2)=0.5mol·L-1,c(B2)=0.1mol·L-1,c(C)=1.6mol·L-1。若 、
、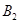 、C的起始浓度分别为a mol·L-1、b mol·L-1、g mol·L-1请确定:
、C的起始浓度分别为a mol·L-1、b mol·L-1、g mol·L-1请确定:
(l)a、g应满足的关系式为_____________。
(2)若反应从正反应方向开始进行,当g=_________,a有最大值为__________。
(3)若反应从逆反应方向开始进行,当b=_________,a有最小值为_________.
(4)b的取值范围为___________________。