聚-3-羟基丁酸酯(PHB),被用于制造可降解塑料等。PHB是由许多3-羟基丁酸分子聚合而成。合成聚-3-羟基丁酸酯的途径很多,其中有一种途径的副产品少、污染小、原子利用率高,其合成路线如下: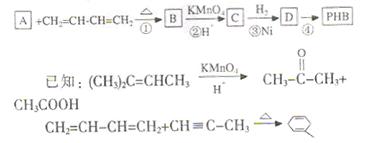
回答下列问题:
(1)写出D中含有的官能团的名称 。
(2)上述转化过程中属于加成反应的是 (填序号)。
(3)反应②符合绿色化学思想(碳原子的有效利用率为100%),则A的结构简式为 。
(4)写出与C互为同分异构体,能发生银镜反应,且分子中仅有两种化学环境 不同的氢的有机物的结构简式
不同的氢的有机物的结构简式  。
。
(5)写出反应④的化学方程式 。
t℃时,将3mol A和1mol B气体通入容积为2L的密闭容器中(容积不变),发生如下反应3A(g)+B(g)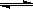 xC(g),2min时反应到达平衡状态(温度不变),此时容器内剩余了0.8mol B,并测得C的浓度为0.4mol·L-1。请填写下列空白:
xC(g),2min时反应到达平衡状态(温度不变),此时容器内剩余了0.8mol B,并测得C的浓度为0.4mol·L-1。请填写下列空白:
(1)从反应开始到平衡状态,生成C的平均反应速率为____________________。
(2) x=____。
(3)若向原平衡混合物的容器中再充入a molC,在t℃时达到新的平衡,此时B的物质的量为n(B) = ___________mol。(用含a的代数式表示)
(4)保持温度和容积不变,对原平衡混合物中三者的物质的量作如下调整,可使平衡向右移动的是______(填字母)。
A.均减半 B.均加倍 C.均增加0.4 molD.均减少0.4 mol
(5)如果上述反应在相同温度和容积的容器中进行,起始加入3 molA和3mol B,达到平衡时A的体积分数为a%。其它条件不变时,按下列配比作为起始物质,平衡时A的体积分数大于a%的是(填字母)。
A.2 molC B.1molA、3molB和4molC
C.1mol B和4molC D.6molA和2molB
(15分)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
⑴SO2和O2反应制取SO3的反应原理为:2SO2+O2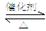 2SO3,在一密闭容器中一定时间内达到平衡.
2SO3,在一密闭容器中一定时间内达到平衡.
①该反应的平衡常数表达式为:.
②该反应达到平衡状态的标志是.
A.v(SO2)=v(SO3) B.混合物的平均相对分子质量不变
C.混合气体质量不变 D.各组分的体积分数不变
⑵某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.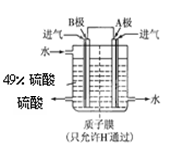
①B电极的电极反应式为;
②溶液中H+的移动方向由极到极;(用A、B表示)
⑶测定绿矾产品中含量的实验步骤:
a.称取5.7 g产品,溶解,配成250 mL溶液
b.量取25 mL待测液于锥形瓶中
c.用硫酸酸化的0.01 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积40 mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式).
Fe2++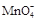 + ——Fe3++Mn2++
+ ——Fe3++Mn2++
②用硫酸酸化的KMnO4滴定终点的标志是.
③计算上述产品中FeSO4·7H2O的质量分数为.
下图表示有关物质之间的转化关系,A、C、E、G为非金属单质,其中A、G常温常压下为气态,E遇淀粉变蓝,K是一种食盐中常用的添加剂,L是常见的无色无味液体,I为淡黄色固体,J的焰色反应呈浅紫色(透过蓝色钴玻璃)。
(1)B、I代表的物质化学式分别为、
(2)写出反应①②的离子方程式:
①
②
(3)选出实验室保存C单质的注意事项(A.无色瓶 B.棕色瓶 C.橡胶塞 D.玻璃塞),除此之外还采取了什么特殊保存方法:
(4)已知A、C、E均能与G反应,按其反应条件要求由高到低顺序为(用化学式表示)
(5)A与H溶液反应,其氧化产物和还原产物的物质的量的比为1:1,写出此反应的化学反应方程式:
(10分) 向容积为2L的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。
已知t3-t4阶段为使用催化剂;图1中t0-t1阶段c(B)未画出。
(1) 若t1=15 min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=。
(2) t4-t5阶段改变的条件为,B的起始物质的量为。各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 |
t2~t3 |
t3~t4 |
t4~t5 |
t5~t6 |
| K1 |
K2 |
K3 |
K4 |
K5 |
则K1、K2、K3、K4、K5之间的关系为(用“>”“<”或“=”连接)。
(3) 在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为。
硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ. SO2+2H2O+I2===H2SO4+2HI
Ⅱ. 2HI H2+I2
H2+I2
Ⅲ. 2H2SO4===2SO2+O2+2H2O
(1) 分析上述反应,下列判断正确的是。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2) 一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
① 0~2 min内的平均反应速率v(HI)=。
② 该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=。
2HI(g)的平衡常数K=。
③ 相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3) 实验室用Zn和稀硫酸制取H2,反应时若加入少量下列试剂中的,产生H2的速率将增大。
a.NaNO3b.CuSO4 c.Na2SO4d.NaHSO3