下图是一种航天器能量储存系统原理示 意图。下列说法正确的是
意图。下列说法正确的是
| A.该系统中只存在3种形式的能量转化 |
| B.装置Y中负极的电极反应式为:O2 + 2H2O + 4e— = 4OH― |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化。 |
下列化学用语中,书写错误的是
A.硫离子的结构示意图: |
B.氟化钠的电子式: |
C.甲基的电子式: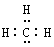 |
D.次氯酸的结构式:H―O―Cl |
PM2.5是指大气中直径小于或等于2.5微米的颗粒物,严重危害人体健康,也称为可入肺颗粒物。近年来我国PM2.5污染问题日益凸显。2012年长沙市开展PM2.5和臭氧监测,每天都公布空气质量级别。下面所列各项,在空气质量日报中完全正确的是
①可吸入颗粒物 ②总悬浮颗粒物 ③氢氧化物 ④二氧化碳 ⑤二氧化硫
⑥二氧化氮 ⑦一氧化碳⑧一氧化氮 ⑨氮气 ⑩臭氧
| A.①③⑤⑦⑨ | B.②③⑤⑥⑦ | C.②④⑥⑦⑩ | D.①⑤⑥⑦⑩ |
下列各组分子中,都属于含极性键的非极性分子的是
| A.CO2H2S | B.C2H4CH4 | C.C60 C2H4 | D.NH3 HCl |
下列说法不正确的是
| A.互为手性异构体的分子互为镜像 |
| B.利用手性催化剂合成可主要得到一种手性分子 |
| C.手性异构体分子组成相同 |
| D.手性异构体性质相同 |
下列现象与氢键有关的是:
①NH3的熔、沸点比VA族其他元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子高温下也很稳定
| A.①②③④⑤⑥ | B.①②③④⑤ | C.①②③④ | D.①②③ |