不能作为元素周期表中元素排列顺序的依据的是
| A.原子的核电荷数 | B.原子的核外电子数 |
| C.原子的质子数 | D.原子 的中子数 的中子数 |
把xmolCO2通过足量的Na2O2后再与ymLNO混合。x与y之和为30mL。设充分反应后气体的体积缩小为15mL, 则x:y为 ①1:1 ②2:1 ③5:4 ④7:5
| A.只有① | B.只有② | C.只有③④ | D.①②③④ |
实验室用浓盐酸与二氧化锰反应制取氯气,下列说法中正确的是(气体体积均在标准状况下测定)
| A.若提供0.4molHCl,MnO2不足量,则可制得氯气2.24L |
| B.若提供0.4molHCl,MnO2过量,则可制得氯气2.24L |
| C.若有0.4molHCl参与反应,MnO2不足量,则可制得氯气2.24L |
| D.若有0.4molHCl被氧化,MnO2不足量,则可制得氯气2.24L |
若以w1和w2分别表示物质的量浓度为a mol/L和b mol/L硫酸的质量分数,且知其2a=b,则下列推断正确的是
| A.2ω1=ω2 | B.ω1=2ω2 | C.2ω1<ω2 | D.ω1<ω2<2ω1 |
下列浓度关系正确的是
A.氯水中:c(Cl2)=2[c(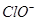 )+c( )+c(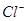 )+C(HClO)] )+C(HClO)] |
B.氯水中:c(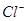 )>c( )>c(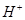 )>c( )>c(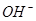 )>c( )>c(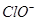 ) ) |
C.等体积等浓度的氢氧化钠与醋酸混合:c(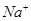 )=c( )=c(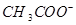 ) ) |
D. 溶液中: 溶液中: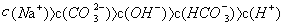 |
下列热化学方程式数学正确的是(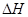 的绝对值均正确)
的绝对值均正确)
| A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
| C.S(s)+O2(g)===SO2(g);△H=-269.8kJ/mol(反应热) |
| D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热) |