一定条件下,对于可逆反应X(g)+3Y(g)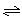 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
| A.c1∶c2=3∶1 | B.平衡时,Y和Z的生成速率之比为2∶3 |
| C.X、Y的转化率相等 | D.c1的取值范围为0.04 mol/L<c1<0.14 mol/L |
下列说法正确的是
| A.由分子构成的物质一定含有共价键 |
| B.由非金属元素组成的化合物不一定是共价化合物 |
| C.非极性键只存在于双原子单质分子中 |
| D.不同元素组成的多原子分子中的化学键一定都是极性键 |
下列说法正确的是
| A.Li是最活泼金属,F是最活泼非金属 |
| B.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 |
| C.X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
| D.Mg(OH)2碱性比Ca(OH)2强 |
若甲烷与氯气以物质的量之比1:3混合,在光照下得到的产物:①CH3Cl②CH2Cl2③CHCl3④CCl4,其中正确的是
| A.只有① | B.只有② | C.①②③的混合物 | D.①②③④的混合物 |
下列变化中属于吸热反应的是
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释
④氯酸钾分解制氧气 ⑤生石灰与水反应生成熟石灰
| A.③④ | B.②③ | C.①④⑤ | D.②④ |
有关叙述:能说明M比N的非金属性强的叙述是
①非金属单质M能从N的化合物中置换出非金属单质N。
②M原子比N原子容易得到电子。
③单质M跟H2反应比N跟H2反应容易得多。
④气态氢化物水溶液的酸性HmM>HnN。
⑤最高价氧化物对应水化物的酸性HmMOx>HnNOy。
⑥熔点M>N。
| A.①②③⑤ | B.②⑤ |
| C.①②③④⑤ | D.全部 |