下列反应的离子方程式书写正确的是( )
| A.将过量锌粉加入氯化铁溶液中:Zn+2 Fe3+==Zn2++2 Fe2+ |
B.将过氧化钠加入水中:2 O +2 H2 O==O2↑+4 OH- +2 H2 O==O2↑+4 OH- |
C.往碳酸镁中滴加稀盐酸:CO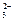 +2 H+=H2O+CO2↑ +2 H+=H2O+CO2↑ |
| D.用澄清石灰水吸收少量的氯气:Cl2+2 OH-==Cl-+ClO-+H2O |
为了保护地下钢管不受腐蚀,可使它与
| A.直流电源负极相连 | B.锡板相连 |
| C.铜板相连 | D.直流电源正极相连 |
下图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的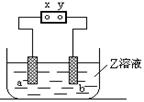
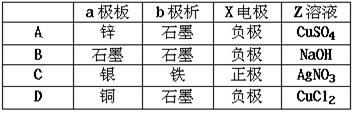
用石墨电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24L(标况)气体,则原混合液中Cu2+的物质的量浓度为
| A.0.5mol/L | B.1mol/L | C.2mol/L | D.4mol/L |
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O=O dkJ·mol—1。根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
| A.(6a+5d-4c-12b)kJ·mol—1 | B.(4c+12b-6a-5d)kJ·mol—1 |
| C.(4c+12b-4a-5d)kJ·mol—1 | D.(4a+5d-4c-12b)kJ·mol—1 |
Fe2O3(s)+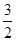 C(s)===
C(s)===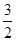 CO2(g)+2Fe(s) ΔH1=+234.1 kJ/mol;C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol;则2Fe(s)+
CO2(g)+2Fe(s) ΔH1=+234.1 kJ/mol;C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol;则2Fe(s)+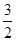 O2(g)===Fe2O3(s)的ΔH是
O2(g)===Fe2O3(s)的ΔH是
| A.-627.6 kJ/mol | B.-824.4 kJ/mol |
| C.-744.7 kJ/mol | D.-169.4 kJ/mol |