反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后
4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后 ,水蒸气的物质的量增加了0.45mol,则此反应的平均速率可表示为
,水蒸气的物质的量增加了0.45mol,则此反应的平均速率可表示为
| A.v (NH3)=0.01mol/(Ls) | B.v (O2)=0.001mol/(Ls) |
| C.v (NO)=0.001mol/(Ls) | D.v (H2O)=0.0 45mol/(Ls) 45mol/(Ls) |
一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应
N2(g)+3H2(g)  2NH3(g) ΔH = -92.2kJ•mol—1,测得0到10秒内,c(H2)减小了0.75mol•L—1,下列说法正确的是()
2NH3(g) ΔH = -92.2kJ•mol—1,测得0到10秒内,c(H2)减小了0.75mol•L—1,下列说法正确的是()
| A.10到15秒内c(NH3) 增加量等于0.25mol •L—1 |
| B.10秒内氨气的平均反应速率为0.025mol•L—1•s—1 |
| C.达平衡后,分离出少量NH3,v正增大 |
| D.该反应的逆反应的活化能不小于92.2kJ•mol—1 |
已知反应:①101 kPa时,2H2(g)+O2(g) ==2H2O(g) H=-483.6kJ/mol
H=-483.6kJ/mol
②稀溶液中,H+(aq)+OH-(aq)==H2O(l) H="-57.3" kJ/mol
H="-57.3" kJ/mol
又知由H2和O2两种气体反应生成1 mol液态水比生成1mol气态水多放出44kJ热量。下列结论中正确的是
| A.H2的燃烧热为285.8 kJ/mol |
| B.H2和O2反应生成液态水时的热化学方程式为H2(g) +1/2O2(g)=H2O(l)△H="-571.6" kJ/mol |
| C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ |
| D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
某温度下,在恒容密闭容器中充入NO2,发生反应2NO2(g) N2O4(g) ΔH <0,达到平衡后,下列说法不正确的是()
N2O4(g) ΔH <0,达到平衡后,下列说法不正确的是()
| A.再充入少量NO2,达平衡后NO2的转化率升高 |
| B.再充入少量NO2,达平衡后NO2的体积分数增大 |
| C.再充入少量N2O4,达平衡后NO2的体积分数减小 |
| D.升高温度,体系的颜色加深 |
2SO2(g) + O2(g)  2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
| 甲 |
乙 |
丙 |
||
| 起始物质的量 |
n(SO2) / mol |
0.4 |
0.8 |
0.8 |
| n(O2) / mol |
0.24 |
0.24 |
0.48 |
|
| SO2的平衡转化率 / % |
80 |
α1 |
α2 |
下列判断中,正确的是()
A.乙中SO2的平衡转化率大于80 %
B.该温度下,乙达平衡时间小于甲
C.平衡时,丙中c(SO3)是甲中的2倍
D.平衡时,甲中O2的转化率大于乙中O2的转化率
已知某可逆反应aA(g) + bB(g)  cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图。下列叙述正确的()
cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图。下列叙述正确的()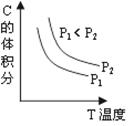
| A.正反应为吸热反应 |
| B.降低温度,正反应速率增大 |
| C.a + b < c + d |
| D.增大压强,B转化率增大 |