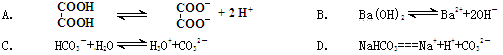下列有关反应离子方程式错误的是 ( )
| A.KOH溶液与过量的SO2反应: OH—+SO2==HSO3— |
| B.Na2SO3溶液与稀硫酸反应 SO32—+2H+==SO2↑+H2O |
| C.NaHSO3溶液中通入氯气:HSO3—+Cl2 +H2O==SO42—+3H++2Cl— |
| D.石灰石与稀硝酸反应:CO32—+2H+==H2O+CO2↑ |
用惰性电极进行电解,下列说法正确的是
| A.电解稀硫酸溶液,实质上是电解水,故溶液中c(H+)不变 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液中c(OH-)减小 |
| C.电解硫酸钠溶液,在阴极上和阳极上析出的产物的物质的量之比为1∶2 |
| D.电解硝酸银溶液,在阴极上和阳极上析出的产物的物质的量之比可能不为4∶1 |
有关如图所示原电池的说法正确的是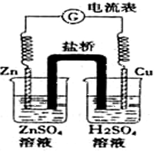
| A.随着反应进行,左烧杯中盐溶液浓度上升,右烧杯中酸溶液浓度下降 |
| B.盐桥的作用是让电子通过,以构成闭合回路 |
| C.随着反应进行,右烧杯中溶液pH变小 |
| D.总反应为:2H++ Zn ="==" H2↑+ Zn2+ △H>0 |
对于氨水的电离,下列哪个量只随温度变化而变化
| A.溶液的pH值 | B.电离度 |
| C.电离平衡常数 | D.平衡后,氨水的电离速率 |
反应A+B→C ΔH<0分两步进行:①A+B→X ΔH>0,②X→C ΔH<0。下列示意图中,能正确表示总反应过程中能量变化的是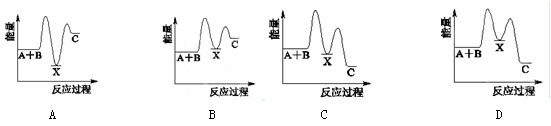
下列电离方程式正确的是