X、Y、Z、W为四种短周期主族元素。其中X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是:
| A.X与W可以形成W2X、W2X2两种化合物 |
| B.Y元素最高价氧化物对应水化物的化学式为H2YO4 |
| C.Z的氢化物的沸点比X的氢化物的沸点高 |
| D.Y、Z两元素的简单离子的半径Y>Z |
下列说法正确的是
| A.最外层电子排布为ns2的元素一定处于周期表IIA族 |
B.主族元素X、Y能形成 型化合物,则X与Y 的原子序数之差可能为2或5 型化合物,则X与Y 的原子序数之差可能为2或5 |
| C.氯化氢的沸点比氟化氢的沸点高 |
| D.同主族元素形成的氧化物的晶体类型均相同 |
某物质有以下性质:①是电解质②溶解时有化学键的破坏③熔化时没有化学键的破坏,则该物质固态时属于
| A.原子晶体 | B.离子晶体 | C.分子晶体 | D.金属晶体 |
X、Y、Z三种元素的原子,其最外层电子排布分别是ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是
| A.XYZ2 | B.X2YZ3 | C.X2YZ2 | D.XYZ3 |
下列有关物质结构的表述正确的是
A.次氯酸的电子式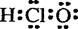 |
B.钠离子的结构示意图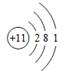 |
| C.硫原子的最外层电子排布式3s23p4 |
| D.二氧化硅的分子式 SiO2 |
用NA表示阿伏加德罗常数,下列说法正确的是
| A.22.4LCl2中含有NA个Cl2分子 |
| B.1L 0.1mol•L-1Na2SO4溶液中有0.1NA个Na+ |
| C.1 molH2与l molCl2反应生成NA个HCl分子 |
| D.1 molCa变成Ca2+时失去的电子数为2NA |