(10分)类推法是科学学习的重要方法之一
(1)下列类推结论正确的是:
| |
类比对象 |
结论 |
| A |
Cl2+H2O HCl+H HCl+H ClO ClO |
I2+H2O HI+HIO HI+HIO |
| B |
C+2CuO  2Cu+CO2↑ 2Cu+CO2↑ |
C+SiO2  Si+ CO2↑ Si+ CO2↑ |
| C |
Na2O+H2O ="=" 2NaOH |
CuO+H2O ="=" Cu(OH)2 |
| D |
Ca(ClO)2+CO2+H2O="=" CaCO3↓+2HClO |
Ca(ClO)2+SO2+H2O="=" CaSO3↓+2HClO |
(2)在学习了卤族元素的各种性质后,如下表所示,表格提供的是氧族元素的部分性质.请结合元素周期律完成下列问题:
| 元素 |
8O |
16S |
34Se |
52Te |
| 单质熔点(℃) |
-218.4 |
113 |
|
450 |
| 单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
| 主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
| 原子半径 |
逐渐增大 |
|||
| 单质与H2 反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
①硒的熔点范围可能是_______ ;②碲的化合价可能有_______ ;
③硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式);
④氢硒酸有较强的________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为___________________________________。
高铁酸钾是一种重要的水的处理剂,实验可用下列流程制取高铁酸钾,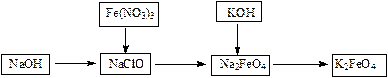
⑴NaClO溶液中加入NaOH固体形成碱性环境。
⑵将研磨的Fe(NO3)3少量多次的加入到上述溶液中,冰浴中反应1h。
采用少量多次加入,其目的是___________________________;该反应的离子方程为:
_____________________________________。
⑶将KOH加入到反应后的溶液搅拌半小时。静置,抽滤的粗产品。该反应的化学方程式为:_____________________________。
⑷依次用甲苯、乙醇、乙醚洗涤以除去水份和KNO3、KCl、KOH等杂质。
⑸在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色。现称取5.000 g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL容量瓶中,定容,量取25.00mL,再用稀硫酸酸化,用0.1000 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,用去标准溶液33.33 mL。
①滴定时适宜选用的滴定管是:(a、酸式,b、碱式)。
②计算上述实验制得的样品中,高铁酸钾的质量分数为_________________。
③若上述过程中,测得的样品中高铁酸盐的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________。
以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质且利用率较高。合成路线如下: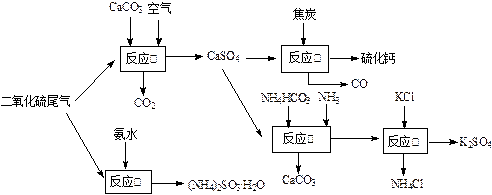
⑴生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 。
⑵下列有关说法正确的是_______________。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS +4CO↑ CaS +4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
⑶反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是_________________________。
⑷(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,若某尾气含标准状况试写出二氧化氮与亚硫酸铵反应的化学方程式___________________________。
已知X、Y、Z、W四种短周期主族元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,X、Y、Z原子序数之和为40,最外层电子数之和为10。据此回答下列有关问题:
⑴X、Y、Z处于____________周期。
⑵若Z原子最外电子数是Y原子最外层电子数的2倍。则元素Y的最高价氧化物对应水化物在水中的电离方程式为_______________;X和W形成的化合物XW2的电子式为________。
⑶若X、W能形成1:1型离子化合物,则其水溶液呈_______性(填“中”、“酸”、“碱”),
并写出电解YZ2溶液的化学方程式___________________________。
加碘盐可防止碘缺乏病,目前加碘盐中加入的是碘酸钾。碘酸钾晶体通常情况下有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂作用生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等强氧化剂氧化为更高价的碘的含氧酸盐。工业上制碘酸钾的方法是:将碘单质与氯酸钾混合后加入稀酸酸化加热可反应生成碘酸氢钾及氯化钾、氯气。加热使所有的氯气都逸出。冷却结晶后可得到碘酸氢钾晶体,再溶解于水得到碘酸氢钾溶液。用KOH溶液调节pH值,再蒸发结晶即可得到碘酸钾。
(1)已知下列反应中,两种还原产物所得电子数目相同,请配平该反应的化学方程式:
□I2+□KClO3+□H2O→□KH(IO3)2+□KCl+□Cl2↑。
(2)在生成碘酸氢钾时用稀酸酸化时不能用盐酸,因为盐酸会与碘酸氢钾反应而生成氯气、碘单质及氯化钾,请写出反应的化学方程式。
(3)如果在得到碘酸氢钾后省略了“加热使所有的氯气都逸出。冷却结晶后可得到碘酸氢钾晶体,再溶解于水得到碘酸氢钾溶液。”直接用KOH溶液调节pH,则可能会导致碘酸钾的产率;原因是。
(4)用题给的方法生产碘酸钾时,得到的碘酸钾23.54g与KClO溶液混合反应后得到的高碘酸钾为23g,试写出反应的离子方程式,则该碘酸钾的纯度为
已知在同一碳原子上连有两个羟基的化合物是极不稳定的,它会自动脱去一分子水生成含有羰基的化合物。化合物A为苯的同系物,aL A的蒸汽完全燃烧消耗相同状况下O29aL。关于A的一系列转化关系如图所示。
其中C能发生银镜反应,并且C在浓碱条件下可以发生自身氧化还原反应生成E和F。回答有关问题
(1)反应①②③④⑤中,属于取代反应的有___________________(填序号)。
(2)B是反应①的产物之一,写出反应①其他可能的产物的结构简式__________________。
(3)写出反应③的化学方程式_____________________________,
写出反应④的化学方程式_____________________________________。
(4)G属于酯类的同分异构体有______种(不包含G),写出其中任意2种的结构简式____________。