相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g) 2SO3(g)+197 kJ。实验测得起始、平衡时的有关数据如下表:
2SO3(g)+197 kJ。实验测得起始、平衡时的有关数据如下表:
| 容器[] |
起始各物质的物质的量/mol[来] |
达到平衡时体系能量的变化 |
|||
| SO2 |
O2 |
SO3 |
Ar |
||
| 甲 |
2 |
1 |
0 |
0 |
放出热量:Q1 |
| 乙 |
1.8 |
0.9 |
0.2 |
0 |
放出热量:Q2 |
| 丙 |
1.8 |
0.9 |
0.2 |
0.1 |
放出热量:Q3 |
下列叙述正确的是
| A.Q1=Q2=Q3 |
| B.达到平衡时,丙容器中SO2的体积分数最大 |
| C.甲、乙、丙3个容器中反应的平衡常数相等 |
| D.若在上述条件下反应生成2molSO3(s)的反应放热小于197 kJ |
下图为元素周期表中短周期的一部分,下列说法正确的是
| ① |
② |
③ |
| ④ |
⑤ |
⑥ |
A.①~⑥可能全部是非金属元素
B.对应单质的活泼性:②>③
C.④的最高价氧化物对应的水化物可能为两性物质
D.②、⑤的最高价氧化物对应的水化物可能均为强酸
有关下列溶液的叙述正确的是
| A.醋酸与醋酸钠的混合溶液中:c(CH3COO-)+ c(OH-) = c(Na+) + c(H+) |
| B.1 mol·L-1Na2CO3溶液中:c(OH-) = c((H+) + c(HCO3-) + c(H2CO3) |
| C.0.1 mol·L-1的硫酸铵溶液中:c(SO42-) >c(NH4+)>c(H+)> c(OH-) |
| D.将1molKCl、1molNaHS溶于水配成1L混合溶液中: |
n(K+) = n(S2-)+n(HS-)+n(H2S) = 1mol
下列实验操作不正确的是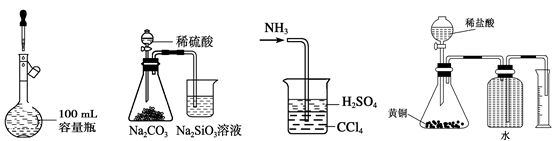
A. B. C. D. A.定容
A.定容
B.比较硫、碳、硅三种元素的非金属性强弱
C.处理尾气
D.测定黄铜(Cu、Zn合金) 中Zn的含量
某有机物的分子结构如图(图中棍表示单键、双键或叁键),它属烃的含氧衍生物。关于该有机物的叙述正确的是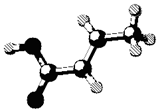
| A.该有机物的化学式为C6H6 |
| B.该有机物可发生取代反应和加成反应 |
| C.该有机物可使溴水褪色,但不能与NaOH溶液反应 |
| D.该有机物是乙酸的同系物 |
下列离子方程式正确的是
| A.用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2 = NO+2NO↑+H2O |
B.NH4HCO3溶液与足量KOH浓溶液共热:NH+OH-  NH3↑+H2O NH3↑+H2O |
| C.铁溶于足量的稀硝酸,溶液变黄:3Fe+8H++2NO= 3Fe2++2NO↑+4H2O |
| D.NaHSO4溶液与NaOH溶液混合:OH-+H+= H2O |