取一定量可能含有Cu(NO3)2、AgNO3、KNO3三种物质中的一种或多种成分的粉末,加热后得到A气体a L,将气体用足量的水吸收,剩余气体B的体积为a/6 L。下列相关推测正确的是
| A.NO2与O2的体积比为5:1 |
| B.气体B可能是NO2 |
| C.NO2与O2的体积比为2:1 |
| D.固体粉末的组成为n[Cu(NO3)2]:n(AgNO3):n(KNO3)=1:3:1 |
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物n(NO2) :n(NO)=1 :1时,下列说法不正确的是
| A.反应中Cu2S是还原剂,Cu(NO3)2、CuSO4是氧化产物 |
| B.参加反应的n(Cu2S) :n(HNO3)=1 :7 |
| C.产物n[Cu(NO3)2] :n[CuSO4]=1 :2 |
| D.1 molCu2S参加反应时有10 mol电子转移 |
双隔膜电解池的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气。对该装置及其原理判断正确的是
| A.a气体为氢气,b气体为氧气 |
| B.A溶液为氢氧化钠,B溶液为硫酸 |
| C.c隔膜为阳离子交换膜、d隔膜为阴离子交换膜 |
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O 2H2SO4+4NaOH+O2↑+2H2↑ 2H2SO4+4NaOH+O2↑+2H2↑ |
短周期元素X、Y、Z、W、U原子序数依次递增。X与W位于同一主族,Z元素的单质既能与盐酸反应也能与NaOH溶液反应,W原子的最外层电子数是次外层电子数的一半,Z、W、U原子的最外层电子数之和为13。Y元素的单质在X的某种氧化物中可燃。下列说法正确的是
| A.X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X |
| B.Y、Z元素的单质作电极,在NaOH溶液中构成原电池,Z电极上产生大量气泡 |
| C.室温下,0.05 mol·L-1 U的气态氢化物的水溶液的pH>1 |
| D.Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
某烃有两种或两种以上的同分异构体,其某一种同分异构体的一氯代物只有一种,则这种烃可能是
①分子中含有7个碳原子的芳香烃②分子中含有4个碳原子的烷烃
③分子中含有12个氢原子的烷烃④分子中含有8个碳原子的烷烃
| A.③④ | B.②③ | C.①② | D.②④ |
有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是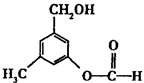
①可以使酸性高锰酸钾溶液褪色
②可以和NaOH溶液反应
③在一定条件下可以和乙酸发生反应
④在一定条件下可以发生消去反应
⑤在一定条件下可以和新制Cu(OH)2反应
⑥在一定条件下可以发生缩聚反应生成高分子化合物
| A.①②③⑥ | B.①②③④ | C.①②③⑤ | D.①②③④⑤ |